Quelques-uns des principaux sujets de Géoforum

▲ Bourse minéraux et fossiles à PARIS ▲ |
-
Compteur de contenus
2804 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par phoscorite
-

Quartz rose?
phoscorite a répondu à un sujet de Croisette99 dans Demandes d' identification de minéraux
Hello Il me semble que ça sert d’hémostatique. -

Identification de 3 roches trouvées sur la plage
phoscorite a répondu à un sujet de Pascal47 dans Demandes d' identification de minéraux
Bien d'accord, je n'avais pas essayé de grossir l'image. La pyrite est bien plus probable. -
-

Dépot sur quartz ? Oxydation ?
phoscorite a répondu à un sujet de Davy 74 dans Demandes d' identification de minéraux
Facile a tester avec la dureté et la luminescence -

Identification de 3 roches trouvées sur la plage
phoscorite a répondu à un sujet de Pascal47 dans Demandes d' identification de minéraux
Intéressant. Dans la cavité de la photo 9, on dirait de la chalcopyrite. Chaque géode est entourée d'un anneau de silice (calcédoine ?) et l'association de ces géodes coalescentes est assez étrange. On peut se demander si ça ne reproduit pas l'architecture d'un fossile ??? -

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
Bonsoir Je n'ai rien repéré de fabuleux, mais je ne suis pas un collectionneur averti. J'ai tilté sur quelques jolies scapolites mauves du Pakistan ; dommage le vendeur ne connaissait pas le contexte geologique, et sur des concrétions mamelonnées de clinochlore ("seraphinite") Russes Pas eu le temps de faire des photos, j'ai été un peu débordé. Si les autres membres du GGN en font passer, je ferai suivre. -

Identification de ce minéraux !
phoscorite a répondu à un sujet de Ismageo dans Demandes d' identification de minéraux
Le vert du cpx est très léger, a peine perceptible. Le minéral vert soutenu dans lequel on ne voit qu'un clivage fin est probablement une amphibole car il corrode le cpx, mais il faut vérifier que l'extinction n'est pas droite, ça aurait pu être en partie de la chlorite. La section presque éteinte, verte en LPNA, sous les petits opaques, pourrait aussi bien être de la chlorite à plat. Pour identifier l'OPX, il faut voir une extinction droite par rapport a un clivage fin. Pour distinguer diopside/salite/hedenbergite de l'augite, c'est pas coton. Le 2Vz de l'augite est un peu plus faible, de même que les teintes de polarisation. -

Identification de ce minéraux !
phoscorite a répondu à un sujet de Ismageo dans Demandes d' identification de minéraux
C'est à coup sur de la calcite, à peu près au centre, on voit bien les macles mécaniques dans deux directions. Les teintes de polarisation ont l'air normales (CPX dans le 2° ordre) mais c'est vrai qu'il y a des franges bizarres sur la gauche en LPA et des rayures sous la préparation visibles en LPNA dans le même secteur. L'OPX me surprendrait : le pyroxène est un peu vert en LPNA. L'amphibole peut être rétrograde ; ce n'est pas bien clair, mais elle peut corroder un peu le CPX au centre de la lame -
"en soi", latin ou grec, je ne sais plus, mais pas "per se polis" Ma traduction est incertaine, mais je comprends qu'il s'agissait d'une collection de minéraux à vocation scientifique et non d'une pièce dans un cabinet de curiosités.
-

Minéraux du Lot
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Cette morphologie externe ne pourrait pas évoquer une pseudomorphose de sphalérite ? -

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
Hello Je vous y attendrai aussi. Il y aura 3 binos en ligne pour mater les petites scapolites d'Arignac et un atelier expérimental ou on essayera d'en trier les minéraux. sable_arignac.mp4 Exemple sur le sable issu des attaques acides -
Pour un point de vue épistémologique sur les reconstructions du passé, on peut voir l'introduction de feu Stephen Jay Gould dans Le Livre de la Vie (coll Science ouverte, Seuil).
-
Les rochers en haut a droite, ils ne sont pas en place, ils auraient du être entrainés par le courant et couchés sur le fond.
-
Les mêmes marbres à minéraux d'Arignac, mais focalisé sur les amphiboles. Certaines sont assez sombres (riches en Fe) et je les vois souvent s'enraciner sur des petits amas ou des filonnets de pyrite D'autres sont plus claires, fibreuses voire courbes (plutôt des trémolites/actinolites j'imagine).
-

Nom de cette roche
phoscorite a répondu à un sujet de Ismageo dans Demandes d' identification de minéraux
Plus compliqué que prévu. Il y a au moins trois minéraux colorés en plus du feldspath. Les rares taches noires sont probablement de la biotite. Les taches vertes plutôt un pyroxene ou une amphibole. Pour le minéral un peu rosé, peut être du sphene. Ça reste très conjectural... Je reste sur une impression de pegmatoide plutonique style syenogabbro. Remarquable en tout cas. -
Oui pour l'acide et oui aussi pour des amphiboles.
-
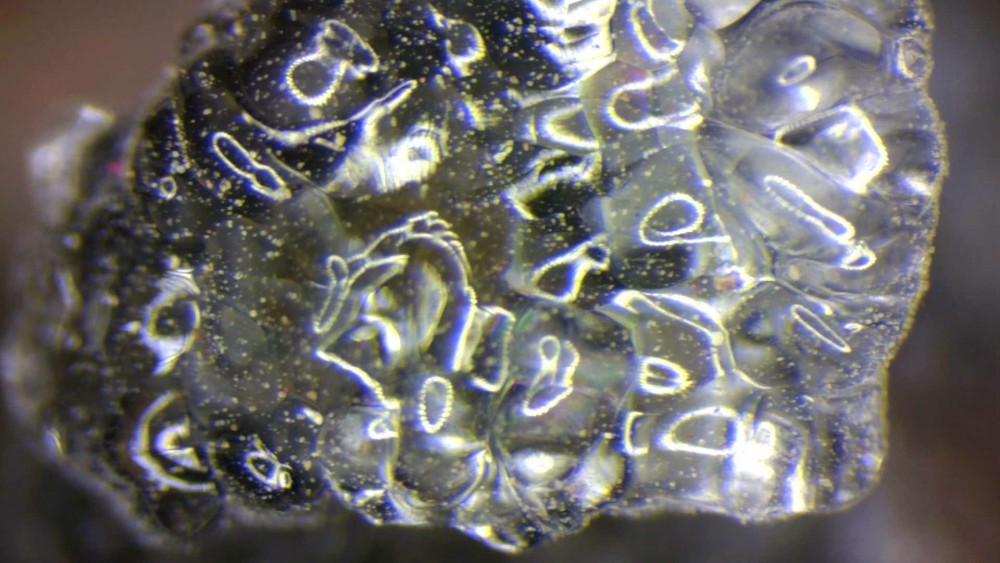
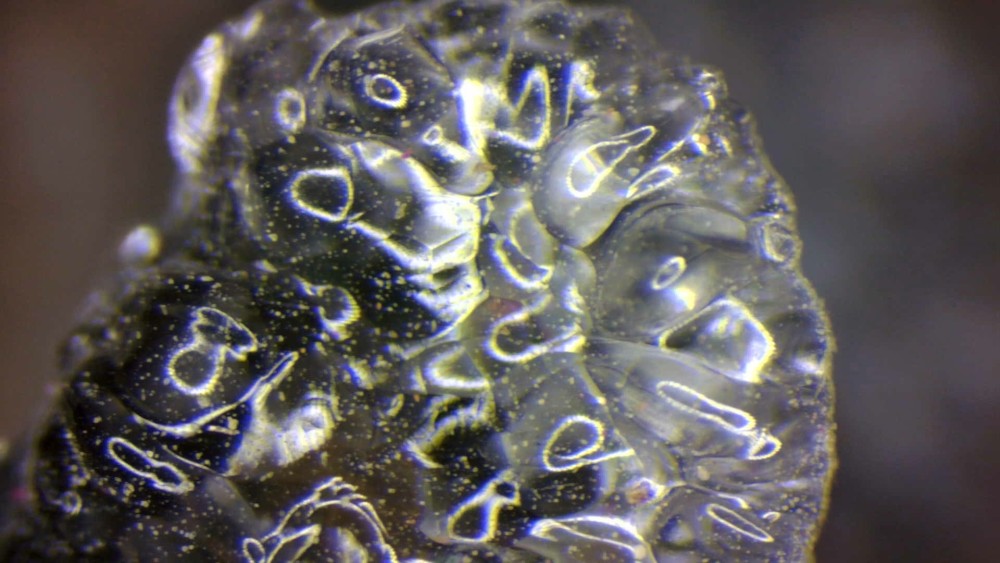
Super ton quartz alpin, Nico... J'en remets une couche de bâtonnets de scapolites d'Arignac (09) à la bino, FOV 2.5 mm.
-

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
Rien de plus précis que Miocène et "autour de Narbonne". L'original est dans la collection perso de Jacques Vidal, GGN Narbonne. -

Minéraux inconnus ?
phoscorite a répondu à un sujet de laroche85 dans Demandes d' identification de minéraux
Bonjour Il me semble que quelques tests s'imposent. Tester la réaction a l'acide des parties blanches (photos 3 et 4). Tester la dureté des parties grises au couteau. Je vois bien les octaèdres, mais ce n'est pas de la pyrite, ils ne sont pas jaunes et ils ont l'air translucides sur les photos, à vérifier de visu. -

Hyalite ou encore de ..de...
phoscorite a répondu à un sujet de phénacite2 dans Demandes d' identification de minéraux
Un petit coté art de Caux avec le reflet de l'anneau lumineux de la bino On devine aussi quelques aiguilles de zeolite (sauf si c'est de l'aragonite) qui m'avaient echappé avant de regarder a la bino -
Bonjour Non, pas de compression sérieuse la-dedans, on verrait une orientation, juste de la fracturation. On ne sait pas trop si c'est de la frac hydraulique (fluide en surpression) ou simplement mécanique (dans un jeu de faille). La taille des fragments de roche est assez petite, mais la plupart ont été ressoudés entre eux par de la silice, seuls les plus gros espaces sont restés ouverts, puis tapissés de petits quartz.
-

Nom de cette roche
phoscorite a répondu à un sujet de Ismageo dans Demandes d' identification de minéraux
Pour un pegmatoïde (i.e. une zone à grain très grossier) dans une roche plutonique, si la minéralogie est la même dans et autour de la poche, le plus simple est de conserver le nom de la roche encaissante. Ici, si c'est bien amphibole + plagioclase, ce serait un gabbro. -
Très intéressante cette faculté des scapolites de jouer les caméleons.
-

Aigue-marine (un peu) atypique
phoscorite a répondu à un sujet de gars de falaises dans Forum Minéraux et Minéralogie
C'est lié, on peut difficilement obtenir un paquet de spaghettis pas cuits si la croissance ne se fait pas principalement selon l'axe. Et les minéraux qui peuvent faire ça comme la tourmaline ont ce type de croissance en commun avec les beryls. Le paradoxe est ailleurs, il faut imaginer un autre mécanisme pour démarrer la formation d'un gros monocristal. -
Si ce l'on veut dater, c'est la formation de la brèche, c'est un problème d'age relatif des terrains, et il faut voir quel est l'age des formations qui sont affectés, ou ne le sont pas. Si on veut dater le phénomène hydrothermal (la precipitation du quartz dans les vides laissés par la breche), il n'y pas de méthode geochronologique standard à ma connaissance.