Quelques-uns des principaux sujets de Géoforum

▲ Bourse minéraux et fossiles à PARIS ▲ |
-
Compteur de contenus
2804 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par phoscorite
-

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
OK, c'est assez convainquant pour de la corrosion, cristaux négatifs et autres formes bien régulières et assez crédibles pour moi. J'aurais préféré voir des zonations chimiques de croissance interrompues par des formes négatives, mais apparemment cela n'a pas été tenté : pas de cartographie chimique de sections de cristaux, dommage. Ceci dit, les auteurs n'envisagent rien d'autre que la corrosion pour expliquer les formes et celles qu'ils montrent sont bien plus régulières que ce que nous a fait voir @otto lidenbrock. Et il n'est pas question dans ce papier d'une recristallisation éventuelle, alors que le Be issu de la corrosion a bien du aller quelque part, et que plusieurs stades de corrosion sont invoqués. Sur les mécanismes chimiques de corrosion, la richesse en F du système doit y être pour quelque chose, mais comment on passe en système pratiquement fermé d'un milieu qui précipite du béryl a un autre qui le corrode n'est pas du tout explicité. C'est peut être discuté dans les papiers en Russe, inaccessibles pour moi. Pour illustrer, des figures de corrosion dans du diopside, obtenues en manip par attaque acide; ça peut aussi être assez déroutant -

Les sapins obscurs ont une âme claire
phoscorite a répondu à un sujet de phoscorite dans Forum Minéraux et Minéralogie
Bonjour, et merci bien pour ces remarques. Oui, il est tout-à-fait possible que je me sois planté sur l'orientation de la macle dans les sapins d'Albas. En fait je n'ai pas exploité la proposition de Cotellucci (Journal of Applied Cryst 2023) sur l'orientation des inclusions fluides car je ne les voyais pas, et que j'avais un gros doute sur la nature des stries : plutôt des rayures que des clivages. Je me suis donc basé uniquement sur la position des axes optiques là ou j'ai pu la relever et estimé l'angle entre les orientations de part et d'autre du plan de macle, ce qui est l'autre méthode pour distinguer un fer de lance d'une queue d’hirondelle. Mais cela été fait rapidement, sur un seul cas, et il faut que je refasse le travail plus proprement (repolissage des lamelles // 010 sans tout arracher cette fois, puis montage et observation au micro polarisant). On aura peut-être alors une orientation fiable des inclusions noires par rapport aux axes du cristal, de chaque coté des macles. Il serait peut être malin aussi qu'on les regarde dans une direction perpendiculaire au plan de clivage facile 010, mais la préparation risque d’être encore plus sportive. Concernant une autre remarque de @Pointcarré dans le post sur "cinquante nuances de gypse", oui, je suis bien conscient que l'adsorption de molécules organiques (humiques ou autres) est de nature à empoisonner la croissance dans la direction de l'axe c, celle qui habituellement est rapide dans le gypse, et de favoriser par différence les croissances normales à cet axe, conduisant entre autres à la forme lenticulaire. C'est ce que disent Cody and Co, expérimentations à l'appui. Il y a aussi le rôle éventuel de la nucléation secondaire sur des surfaces empoisonnées et son impact sur la nature des macles. A ce propos, je n'ai identifié aucune macle par pénétration dans les sapins d'Albas (11), pas de rosette non plus, alors que ça a l'air fréquent dans ceux de Sinard ; les connaisseurs me contrediront si besoin, merci d'avance à eux. Mais discuter l'adsorption de molécules organiques nécessite des données expérimentales, alors que ce que nous voyons dans nos sapins ce sont seulement des différences de couleur du gypse (clair au cœur, miel dans les pointes à Albas), éventuellement des zonations dans la luminescence, et la répartition des inclusions noires qui ont été englobées ou repoussées par la croissance des cristaux. C'est avec ça qu'il faudrait raisonner, si on peut. -

Madagascar, quelques photos et des conseils a partager si nécessaire.
phoscorite a répondu à un sujet de Outlander dans Forum Minéraux et Minéralogie
On dirait qu'il y a un autre minéral, dans le centre du même spécimen, qui forme des prismes gris enchevêtrés a section carrée ? -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Merci beaucoup, on va essayer de décoder ce papier. -
Merci à vous deux pour ces développements très intéressants, et pour la référence à Masaru Taga (2011). Ma propre lampe UV ne suffit pas à faire avancer le schmilblick, trop de lumière visible parasite. Concernant la relation très intéressante entre inclusions, macles et morphologie des cristaux, il y a du travail a faire, mais je propose que l'on poursuive cette discussion sur l'autre post "les sapins obscurs ont une âme claire" puisqu'il contient déjà pas mal de photos des inclusions et un début de discussion J'espère qu'il s'agit bien de celles dont parle @Pointcarré
-

Vos minéraux d' Alsace...
phoscorite a répondu à un sujet de Olaf dans Forum Minéraux et Minéralogie
Étrange association, avec 2 sels distincts en plus. -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Le premier est particulièrement troublant. Merci. On aurait la possibilité de savoir s'il y a un seul cristal ou plusieurs ? -

Minéraux du Lot
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Une syncristallisation pyrite / chalcopyrite avec un aspect vermiforme ? -
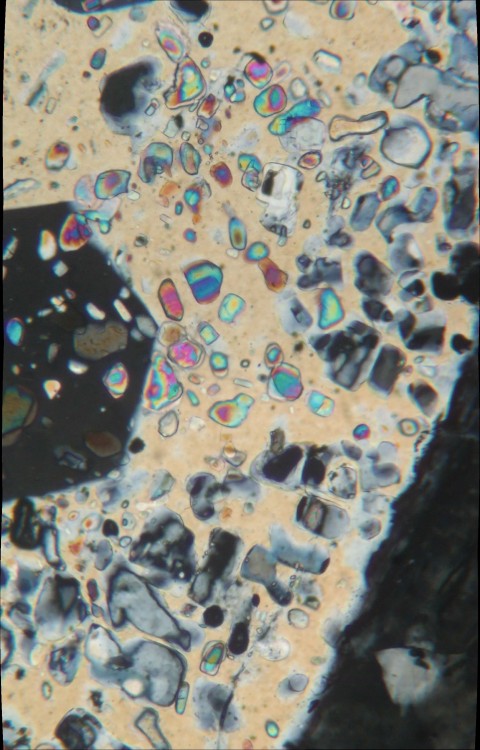
Sans en être spécialiste, on sait un certain nombre de choses sur ces quartz. Ils sont diagenétiques, i.e. formés dans le sédiment déjà enfoui à relativement basse température (<100°). La plupart contiennent des inclusions d'anhydrite, i.e. ils se sont formés dans d'anciens nodules d'anhydrite des évaporites ou à un stade de l'enfouissement ou l'anhydrite avait remplacé le gypse. Des études plus détaillées (par thermoluminescence) suggèrent plusieurs stades de formation, avec un stade de corrosion intermédiaire. Leur age de formation est antérieur au soulèvement des Pyrénées, on les retrouve en abondance dans les sédiments terrigènes du Cuisien. Il y en a beaucoup dans le Trias sup (Keuper), mais ils sont connus aussi dans le Lias inférieur des Corbières (cf notice de la feuille Leucate). L'origine de la silice qui les forme est incertaine. Dégradation de roches silicatées en surface (éventuellement les ophites) par des eaux continentales ? Un exemple de nodule (ex-anhydrite) provenant de Durban (11) sur surface sciée. Et une lame mince dans les quartz qu'il contient (champ 3 mm) Les inclusions d'anhydrite (les couleurs vives en haut sur fond jaune) ; les inclusions du bord du grain (grises, à droite et en bas, sont rétromorphosées en gypse)
-

Erreur de casting ? pérovskite ou pas telle est la question
phoscorite a répondu à un sujet de Kujaku dans Demandes d' identification de minéraux
C'est un mineral iridescent associé a une masse noire qui pourrait etre de la perovskite. On devine dans la masse noire des clivages qui pourraient bien relever du système cubique, compatibles avec perovskite. Il reste a apprecier les relations geometriques entre les deux mineraux ; sur l'une des photos, la premiere de la derniere série, on a l'impression que la masse sombre recoupe le mineral iridescent. Pour le mineral iridescent, on pourrait imaginer avoir affaire a un pyroxene, l'iridescence pouvant etre associée a des exsolutions. Je ne vois pas assez bien les clivages dans ce mineral pour faire avancer le schmilblick. -

Erreur de casting ? pérovskite ou pas telle est la question
phoscorite a répondu à un sujet de Kujaku dans Demandes d' identification de minéraux
Oui, la matrice des perovskites c'est en general une carbonatite ou une roche silicatée très alcaline, qui contiendrait des feldspathoides plutot que du feldspath. Le labrador est un feldspath. Ce n'est pas vraiment le meme monde. -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
En effet, et bravo pour cet effort des organisateurs. La littérature sur "mineral replacement" est énorme, pas seulement pour les mineralos, c'est aussi un sujet pour le génie chimique (cristallisation industrielle, pharmacie...). Et le point de vue des expérimentateurs est passionnant. Me contacter par MP si intérêt. -
Commençons par un test a l'acide, pour voir s'il y a du carbonate, on ne sait jamais, puis la dureté des minéraux clairs. Ça a une bonne tête de roche plutonique, même si on ne comprend pas trop la figure de réaction autour du minéral brun. Peut être de l’orthopyroxène, regarder les clivages de près.
-

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Merci, cette fois je crois comprendre l'argument. Cette croissance un peu "folle" ce n'est pas une caractéristique générale des sceptres par hasard ? -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Bonjour Je n'ai pas compris cette suite de la discussion, en particulier la remarque sur les relations argile kaolin. Plusieurs argiles ? Je suis bien d'accord sur le fait que l'association des béryls avec des poches argileuses ne peut pas être due au hasard, il y a quelque chose d'important a comprendre. Je suis très intéressé par les mécanismes de croissance compétitive, mais je ne vois pas comment on peut argumenter sur un spécimen flottant. Analyser la distribution des inclusions, OK, mais juste à partir de la morphologie externe, je ne vois pas. Il faut avoir de l'info sur l'orientation optique des minéraux avec lesquels le béryl est en compétition. Idéalement, je chercherais des observations en lame mince, ou au MEB sur produit expérimental. -
Merci les poteaux. Il y a effectivement des gypses noirs, ou qui ressemblent aux sapins d'Albas, un peu partout dans les Corbières, la ou les marnes Siluriennes sont bien noires en surface. J'en ai vu près de Durban, plus petits qu'à Albas, mais avec la morphologie typique des sapins. C'est clairement du gypse secondaire, lié a l'oxydation de la pyrite dans des niveaux contenant aussi du carbonate. Ca vaudrait la peine de travailler sur la répartition des inclusions de matière organique dans ces gypses, on pourrait peut-être en tirer des infos sur les mécanismes de croissance. Les figures que vous montrez ici sont assez différentes de ce que je vois a Albas, ou a Durnban.
-

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
On aura difficilement le fin mot de cette histoire, trop de minéraux dans les paragenèses tardives et pas assez de relations géométriques. Il faudrait remonter a une description détaillée dans une thèse, si cela existe. Il faudrait aussi comprendre la minéralogie des brèches, et par quoi elles sont cimentées. Ce qui me fait pencher pour un stade de dissolution partielle subsolidus du béryl, c'est la mention dans le texte de Lyckberg d'un alternance de stades d'altération à dominante acide et alcaline, i.e. d'abord acide (probablement micacée), puis alcaline (corrosion du quartz), puis à nouveau acide. Je n'ai pas l'info primaire qui fonde cette analyse, mais ça évoque des souvenirs sur les alternances de stades de greisenisation / feldspathisation (comme dans une épisyenite) puis re-alteration micacée. Il me semble que le béryl pourrait être corrodé dans la phase "alcaline" et qu'on peut envisager de former à ce stade de la phénacite secondaire, phénacite qui serait à son tour détruite pour restaurer la surface du béryl quant on revient à des conditions "acides". Il me semble qu'une information cruciale manque ici, c'est la nature du matériel primaire (magmatique) qui constituait la "leached zone". Pour espérer avoir cette information, il faudrait trouver des descriptions de miarolles plus petites, dans lesquelles l'histoire serait moins complexe. On trouvera peut-être en regardant la doc sur les rapakivis finlandais ou suédois, qui sont plus abondamment décrits. L’expérience nous suggère que les fluides chauds sont fichtrement incapables d’être sélectifs a ce point. Quand ça réagit, ça réagit avec toute la roche, ça corrode et ça précipite en même temps. D’où la difficulté de cerner les réactions chimiques dans un stade d'altération particulier quand il y en a plusieurs qui sont superposés. Il faut espérer tomber sur des poches dans lesquelles certains stades ne sont pas représentés pour espérer comprendre les autres. Le nombre d'observations nécessaires pour en venir à bout augmente de manière exponentielle avec le nombre de phases d'altération. -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Merci pour ce document, qui m'a permis d'aller voir le papier de Lyckberg (2009) sur Volodarsk. Cela ne permet pas de savoir à quelle argile on a affaire exactement dans ces poches, mais la "leached zone" (zone blanchie ou lessivée) qui apparait au mur des miarolles de pegmatite y est décrite comme une zone d'altération de la minéralogie primaire, et dans laquelle se trouve une paragenèse tardive, voire très tardive, avec des températures de cristallisation (je présume à partir des inclusions fluides) qui s'étalent de 600°C jusqu'à 100°C. Une histoire thermique très longue, donc, avec des stades de corrosion avérés, notamment du quartz primaire. Ce n'est probablement pas, comme je l'avais imaginé, de l'altération de surface, mais bien une traine de refroidissement post magmatique qui n'en finit pas. Concernant la question un peu formelle sur la corrosion / croissance compétitive, je ne vois pas ce qui empêcherait les magnifiques figures de surface des béryls d’être interprétées comme le résultat d'une corrosion, probablement suivies d'une restauration partielle (par murissement ou nouveau nourrissage) des surfaces corrodées. Il y a d'autres phases contenant du Be dans la paragenese, qui, en s'altérant à leur tour, pourraient fournir le Be nécessaire à la recristallisation des béryls. Mais ça reste de la conjecture. -

DENVER SHOW 2024
phoscorite a répondu à un sujet de otto lidenbrock dans Forum Minéraux et Minéralogie
Hello. Merci pour ces superbes vues. Comme Greg, je ne suis pas emballé par cette interprétation. Sans avoir vu ce cas, j'aurais instinctivement considéré que le béryl était en relique dans une paragenèse contenant du feldspath, lequel a été totalement argilisé. Le beryl, comme la tourmaline ou d'autres mineraux des pegmatites, étant simplement plus résistant dans l'altération de surface, il est seulement corrodé. -
Une photo peut-etre ? Sinon, la Grece est pleine de complexes ultrabasiques, et la serpentine n'y est pas rare.
-

Identification roche Vosges
phoscorite a répondu à un sujet de babouchekiks dans Demandes d' identification de minéraux
Bonjour Juste de l'altération superficielle d'un granite ou d'un microgranite, avec une arénisation bien avancée. Je ne crois pas trop a une arkose, les micas ne sont pas orientés. -

Le Règne Minéral : c'est fini :-(
phoscorite a répondu à un sujet de greg la veine dans Actualité des associations, dans les médias,...
Tu as bien mis le doigt dessus. Ce n'est pas de la science, mais d'une démarche intellectuelle ou d'une démarche de recherche qu'il faut parler. La science s.s. se définit de nos jours de manière terriblement circulaire : est scientifique celui qui est reconnu comme tel par ses pairs. En prenant ma retraite, j'ai cessé de publier, donc je ne suis plus un scientifique, mais je revendique haut et fort le droit de continuer a faire de la recherche, et de partager mes interrogations. -

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
-

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
-

Bourse de Narbonne
phoscorite a répondu à un sujet de Steph6649 dans Conférences, sorties, voyages, expositions,...
Les voici La plus grande piece est brute, 40 cm de haut Mais la plupart du materiel proposé par le vendeur est poli. Quelques autres surfaces polies de bonne facture : les minerais de Fe (itabirites et Cie) precambriens et d'autres carbonates ou fluos zonés