Quelques-uns des principaux sujets de Géoforum

▲ Bourse minéraux et fossiles à PARIS ▲ |
-
Compteur de contenus
2618 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par Lionel-R
-
Salut Daniel :) La passivation du cuivre... je ne connais pas, le net relate des méthodes utilisant du chrome... J'ai une idée que je n'ai jamais vue mise en place pour des échantillons minéralogique mais elle existe et est très employée dans l'industrie : l'anode sacrificielle. Le procédé est d'une simplicité déconcertante, il faut mettre le métal oxydable en contact avec un métal encore plus oxydable. Le métal idéal pour cela est du zinc et le cuivre doit être connecté électriquement à la plaque de zinc (pince crocodile dans l'idéal avec le risque de rayer le cuivre ou simple contact direct avec le risque d'une mauvaise conduction). Ce procédé est utilisé pour protéger les cuves en acier des stations essence ou la coque des navires. Le cuivre ne s'oxydera que lorsque tout le zinc aura été oxydé. Pour que cela soit efficace il faut que le bloc de cuivre soit monobloc sinon il faut protéger chaque partie séparément.
-
Pas mieux, l'acide que tu veux suffira mais surtout pas d'acide nitrique !!! interdit sur le cuivre !!! INTERDIT !!!
-

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Tout à fait, on verrait en plus l'image géométrique de la fente ce qui est parfaitement inutile en plus d'être gênant. -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Ton problème de longueur d'onde doit provenir de toute une série de défauts du montage : il faut un réseau dont le plan est vraiment perpendiculaire à l'objectif et avoir ces conditions n'est pas une chose évidente ; ceux qui ont déjà réglé un goniomètre le savent très bien. Pour calibrer ton échelle, il faudrait utiliser des sources monochromatiques (laser rouge, vert) ou utiliser des lampes spectrales (mercure, cadmium, sodium) dont la positions des raies est connues avec une grande précision. Bref si on veut être précis, il faut commencer à prendre du bon matoss. Pour le semi quantitatif, le problème est tout autre, on ne regarde que des rapports d'intensité sur un spectre qui sont indépendants de la façon dont on réalise le spectre, il faut une poudre homogène par contre. J'attends tes spectres avec impatience, par contre, c'est ambitieux et difficile, il faudra vraiment beaucoup de temps avant que j'arrive à sortir quelque chose, mais je suis chaud ! -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Il y a une chose que j'aimerai tenter de mon côté. J'aime bien la programmation et j'ai envie de voir ce que l'on pourrait faire en traitant tes résultats avec une série d'algorithmes. Mon idée serait de programmer un affinement des spectres que tu obtiens afin de connaître précisément la position des raies et leur nombre. De cette façon il va être plus simple d'identifier tous les constituants de tes poudres voire même de traiter un échantillon totalement inconnu pour en déduire la composition. Un traitement informatique rigoureux permet aussi de faire de l'analyse quantitative, tout du moins d'en déduire les proportions d'un mélange ce qui est déjà pas mal. Je suis assez familier de ce genre de problème, j'ai fait ça au boulot où j'ai mis au point un outil qui me permet de traiter des spectres de réflexion de poudre (réflexion diffuse). Durant mes études j'ai vu la plupart des algorithmes qui permettent de faire des affinements c'est à dire, trouver la courbe mathématique qui permet de mimer une raie d'un spectre. Je dois juste combiner tout ça pour produire un outil. Il est aussi possible de le faire à la main via Excell, mais j'ai envie d'automatiser le traitement pour que ça soit propre. C'est super ardu, je ne sais pas si je vais y arriver et ça me prendra un temps fou (enfin la dernière fois que j'ai dit ça, je m'en suis sorti donc à voir)... pourrais tu me fournir des spectres pour que je vois ce que je peux faire ? Merci d'avance. -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Concernant la couleur de l'oxyde de chrome, tu commets une petite erreur. Ce que tu fais c'est la formation d'un plasma qui excite les atomes et permet d'observer tout un tas de transitions électroniques dues à la température qui se traduisent par une émission de photos. Dans le cas de la couleur des poudres, c'est plus simple, c'est un autre phénomène, toujours des transitions électroniques : cette fois ce sont les photons de la lumière visible qui sont absorbés et la couleur que l'on observe est complémentaire de la couleur absorbée (dans les cas simples). Continue à bosser !!! -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Eh bien ça alors ! tu vas même chatouiller l'IR et l'UV... chapeau bas, c'est vraiment très beau, ambitieux, courageux et couronné de succès. Il ne reste plus qu'à tenter les analyses déjà faites en regardant plus loin. C'est vraiment trop génial, tu disposes d'un outil d'analyse qualitative parmi les plus puissants ! Avec méthode, tu peux investiguer une composition chimique c'est génial !! Après le verre t'empêchera de dépasser certainement limite : il absorbe l'IR et le l'UV à partir de certaine longueur d'onde et pour l'éviter il faut de l'optique en quartz... Va jusqu'au bout, c'est vraiment chouette. -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
3000°C est de mémoire la température du plasma des ICP, tu vas sans doute plus haut encore, sinon je ne vois pas comment tu pourrais voir les raies de l'hydrogène. Pourrais tu te procurer du molybdène ou du tungstène ? Les températures de fusions sont très élevées devraient nous donner des bornes des température atteintes. Autre question, vois tu les impuretés avec ton système ? Est ce que ça marche avec tous les cailloux ou ils doivent absolument être dissous ? Même avec une poudre finement divisée ? Est ce que ton système contrôle la différence de potentiel lors de la décharge ? Si non, tu peux l'augmenter (et donc chauffer plus et donc avoir une meilleure résolution) en écartant légèrement les broches de ta pince. -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Je suis étonné que tu arrive à voir les raies de l'hydrogène, tu as une idée de la température à laquelle tu montdes ? En ICP on le le voit pas pourtant le plasma n'est pas tendre ! -

Spectrographie et identification des minéraux
Lionel-R a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Je reste pantois :) bravo ! -
A ce prix tu peux avoir une Navajun absolument parfaite et de la même taille, l'objectif est sans doute d'avoir une pyrite chinoise alors ? Mets ces 6.5€ de côté de façon à ajouter ces sous à ton budget quand tu seras face à une pièce plus représentative et plus sérieuse. Il vaut mieux que tu prennes une pièce qui chatouille que 10 pièces dont tu te débarrasseras plus tard parce que tes goûts auront évolué et que tu ne voudras plus les voir. Je parle d'expérience, j'ai viré presque la moitié de ma collection parce que je suis devenu plus exigeant. Si j'avais bien investi dès le départ, ma collection serait plus intéressante. Mais c'est toi qui sait ce que tu veux, mon avis importe très peu.
-
Dans la mesure du possible un échantillon doit être sans défaut, ici toutes les arrêtes sont abîmées. Les cristaux doivent être aussi propres et nets que possible et ici, ils sortent bon gré mal gré d'une matrice pyriteuse terne. Tu peux trouver beaucoup mieux à des prix très raisonnables (deux chiffres). Cherches bien et surtout soit patient. Mais cependant, mon commentaire est tout à fait relatif, le plus important est que la pièce te plaise, si elle te plait prends là, si elle ne plait pas aux autres tant pis pour eux puisque tu es heureux. Sois juste cohérent dans tes choix de collectionneur. Walla :)
-
Tout à fait :)
-
La lépidolite n'est plus reconnue depuis 1989, cette appelation désuète depuis 25 ans fait référence à un membre de la série polylithionite-trilthionite, d'autre part on ne peut afférer son existence qu'avec des analyses, (le lithium ne rend pas les micas violets). La plupart des "lépidolites" du marché sont en fait des muscovites. Il est donc impossible de trancher sur photos, peut-être que des données sur le gisement permettent de conclure indubitablement à un "lépidolite". Les noms désuets ne servent à rien, mais fait avouer que c'est notablement plus simple à écrire :) Point numéro deux, selon toute vraisemblance, la tourmaline est une elbaïte et si on veut vraiment aller pêcher du côté des variétés, on peut dire que c'est une verdélite.
-

La bridgmanite : nouveau minéral en 2014
Lionel-R a répondu à un sujet de Lionel-R dans Forum Minéraux et Minéralogie
Oh si j'ai connu, pendant plus de trois ans, presque 4 et ce n'était pas tendre, mais là, il n'y a pas de pression, rien à publier, rien à prouver, juste de l'échange pur et gratuit, chose qui rend ces comportements puérils vraiment improductifs ici. Mais bon, chacun sa maturité et chacun sa façon de gérer ses blessures narcissiques. Normalement il n'y a pas d'ordre Mg/Fe dans ces structures exactement comme les péridots, sinon on change de structure car la symétrie est différente, elle augmente en ajoutant un ordre cationique. Cela existe dans les pérovskites dans une structure particulière que l'on appelle les doubles pérovskites où exactement un octaèdre sur deux est occupé alternativement pas un cation puis l'autre. Là ce n'est pas le cas, j'ai pu lire la publi de Science et c'est vraiment une pérovskite standard. Au passage les mecs qui ont mené l'étude sont solides... ce n'était vraiment pas simple à faire, la bridgmanite était totalement noyée dans une matrice contenant des phases amorphes et cristallisées. Bravo les gars ! Le fait de mettre de la pression n'impose pas forcément un ordre dans la répartition des cations. Mais cela peut-être observé dans la nature, je n'ai malheureusement pas d'exemples en tête. Tu peux obtenir la même chose avec la température (car on peut observer dans certains système comme CoMoO4, qu'une pression forte est équivalente à une température basse au niveau des liaisons). La post-pérovskite si ma mémoire est bonne est une évolution à pression et température encore plus élevées de la pérovskite de base MgSiO3. Du peu que je sais, il n'y aurait pas de nom pour la structure pérovskite FeSiO3, mais je ne sais pas tout, c'est évident. Il est cependant fortement probable qu'un chimiste du solide l'ait synthétisé, analysé et nommé. Il faut regarder si des russes n'ont pas travaillé sur le diagramme de phase de la ferrosilite ou de la fayalite. -

La bridgmanite : nouveau minéral en 2014
Lionel-R a répondu à un sujet de Lionel-R dans Forum Minéraux et Minéralogie
Il ne doit sans doute pas apprécier la pérovskite cubique, mais à vrai dire ce n'est pas rigoureusement exact : j'ai donnée la structure idéalisée de la perovskite sans entrer dans les détails des distorsions des octaèdres qui abaissent la symétrie de cubique à orthorhombique. Le but était que tout le monde puisse se représenter la maille facilement et en soi, c'est bien de cette façon que l'on montre la structure de la pérovskite aux débutants en cristallographie. En soi, cela n'est pas choquant, je n'aurai peut-être pas dû le passer sous silence, je vais modifier le texte en conséquence par soucis de rigueur. Après quand Mine84 (Alain Abréal) me dira ce qu'il reproche au billet, on pourra en parler et le modifier pour le rendre plus juste. Cela dit, n'est pas la première fois qu'Alain Abréal m'agresse sur ce forum, c'est vraiment très désagréable et cela contribue à l'atmosphère étouffante du lieu. Disputes, polémiques, jalousies, agressions, ça devient vraiment pénible d'échanger ici et ça ne s'arrange pas, le moindre sujet est propice à tous les dérapages. Le résultat est simple : la majorités des contributeurs s'en vont et le niveau du forum chute malgré les nouvelles arrivées. On arrête de faire les enfants ou on continue à transformer le forum en cours de récréation pour gamins immatures ? J'ai juste envie de parler cailloux, pourquoi on vient m'agresser gratuitement ?! C'est quand même incroyable, je prends mon temps pour écrire un petit billet sur une nouvelle importante juste pour partager et faut qu'on vienne me prendre la tête pour des peccadilles parce que j'ai vexé cette personne en osant lui dire qu'il avait manqué de rigueur. Punaise, quel exemple... -

La bridgmanite : nouveau minéral en 2014
Lionel-R a posté un sujet dans Forum Minéraux et Minéralogie
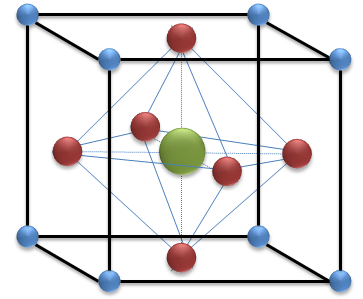
Je ne vais pas réécrire l'article du magazine Pour La Science, bien qu'il mériterait quelques compléments, on découvre de nouveau minéraux très souvent mais celui ci a un statut vraiment très particulier. En effet, on a toujours su qu'il existait sous nos pieds à très grande profondeur des quantités colossale d'un minéral de formule (Mg,Fe2+)SiO3 dont la structure est celle de la perovskite. La structure idéalisée de la perovskite est cubique et on peut décrire assez simplement : Le fer et le magnésium se trouvent au centre du cube et au centre d'un octaèdre d'oxygène chaque oxygène étant au centre d'une des six faces du cubes, le silicium se trouve à chaque sommet du cube. Dans cette structure, les positions des cations divalents (Fe, Mg) et tétravalent (Si) sont interchangeables, c'est à dire qu'on peut la décrire comme une structure cubique avec un silicium en son centre et au centre d'un octaèdre d'oxygène, les dits oxygènes étant toujours placés au centre de chaque face du cube. Cette fois on trouvera le magnésium et le fer aux sommets du cube. (En réalité la perovskite est orthorhombique car les octaèdres d'oxygène subissent des rotations qui provoquent une distorsion de la maille et abaisse sa symétrie, mais nous n'entrerons pas dans ces détails). Schéma de la structure Pérovskite idéalisée (Rouge Oxygène, Vert Fer/Magnésium, Bleu Silicium) Pas extraordinaire comme maille conventionnelle mais du silicium en site octaédrique ça ne se voit pas tous les jours. D'autre part, la formule du minéral rappelle à un oxygène près cette de la forstérite, on imagine alors sans peine que l'on obtient la bridgmanite en appliquant à la forstérite du manteau des pressions et températures très élevées. Cette considération laisse entrevoir sans peine la quantité proprement colossale de bridmanite que l'on peut trouver dans le manteau : pas moins de 38% du volume du manteau, ce n'est ni plus ni moins que le minéral le plus abondant de notre planète. Il semble alors particulièrement étrange que ce minéral aussi abondant soit il ne soit reconnu qu'en 2014 par l'IMA, d'autant que la bridgmanite est connue et étudiée en laboratoire depuis très longtemps. Nombre de scientifiques ont en effet mis de la péridotite du manteau sous haute pression et haute température afin d'observer son comportement chimique, mécanique et surtout les structures cristallines qui apparaissent alors. C'est justement là que réside le problème : la bridgmanite obtenue en laboratoire est très instable dans les conditions usuelles de température et de pression (1bar, 25°C) et pour que l'IMA reconnaisse un nouveau minéral, il doit être observé dans un échantillon NATUREL ! La physicochimie de la matière condensée, plus souvent appelée chimie du solide, et plus précisément la chimie minérale permet d'amender tout un tas de règles de base de la physique. Pour y arriver, il faut être audacieux, astucieux, malin et surtout bien maîtriser sa science. Sheldon le dit souvent : "When you know the laws of Physics, everything become possible", quand on maîtrise les lois de la Physique, tout devient possible. Tout physicochimiste ayant l'ambition, l'audace de découvrir la brigmanite doit donc se tourner vers des météorites. Et cela pour tout un tas de raisons très simples : Les météorites peuvent être relativement riche en forstérite, la matériau de base de la bridgmanite. Les chocs de météorite permettent d'atteindre rapidement des pressions et des températures gigantesques, soient les conditions de formation du minéral. Les conditions de pression et de température extrêmes durent très peu de temps. Les minéraux formés lors de ces étapes courtes sont petits et subissent une trempe rapide. Tout chimiste sait que pour observer une phase très instable, il faut la former vite, la tremper tout aussi vite et ne pas faire de trop gros cristaux dont l'instabilité serait rédhibitoire à toute analyse. Les chocs de météorites remplissent toutes ces conditions et c'est ainsi qu'un échantillon authentique de bridgmanite a été découvert, analysé par diffraction des rayons X et donc reconnu par l'IMA. Echantillon de météorite contenant de la bridgmanite (Pour La Science) La découverte date de 2009, la météorite est celle de Tenam (Australie), l'échantillon est conservé au Smithsonian Institution (Washington DC) Je trouve que c'est une belle aventure scientifique et qu'elle est pleine de bon sens et d'anecdotes purement scientifiques, raison de mon partage avec vous. Les données que je communique sont absentes du document que j'ai lu et que vous pouvez consulter librement ici L'article initial paru dans la revue Science (rien que ça... preuve que c'est important !) est accessible ici il faut être abonné pour lire tout l'article, je n'ai pas ce privilège :( Bonne journée à tous ! -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
J'ai oublié de répondre à ça. Cela doit être sans doute imputable au fer de la sidérite qui a en plus la bonne idée d'avoir le même degré d'oxydation que dans la pyrite (II), il faudrait voir s'il n'y a pas des épitaxies, ça serait marrant même. Faut dire que suivant la direction 001, une sidérite peut présenter des atomes de fer en surfaces, de là à faire germer de la pyrite dessus, pourquoi pas. Après faut pas s'emballer non plus, la pyrite peut cristalliser préférentiellement sur la sidérite parce qu'elle présente les points de germination les plus favorables. C'est moins sexy mais plus simple et plus plausible. -

Minéraux, mes dernières acquisitions...
Lionel-R a répondu à un sujet de pegasus dans Forum Minéraux et Minéralogie
La rhodochrosite à Madan ne coure pas les rues et comme ça je n'en ai jamais vue. On trouve surtout des rosettes ou des ailettes esthétiques quoiqu'un peu douteuses. Pour le coup c'est vraiment chouette d'autant que les encroûtements de ce type sont habituellement dus à de la dolomite. Donc bien joué en effet. Par contre 19x7x7cm ?! Didiou mais c'est énorme !!! Faut dire que tu prends souvent des pièces gigantesques mais là, c'est vraiment gros ! (ce n'est pas une critique !) -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
Va voir là tu verras de la blende (et dans) la fluorite. Mais là bas ce n'est pas fréquent. -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
Je connais bien ces descriptions pour les avoir étudiées longtemps, mais le défaut de Frenkel est toujours ponctuel dans ces schémas et je ne vois pas ce qui pourrait l'étendre, pire, je ne comprends pas comment ce défaut pourrait produire une couleur, aucun électron n'est affecté par ce défaut, ce n'est pas un centre coloré. Ou alors, un électron pourrait se trouver coincé dans la lacune créée ?! Un peu comme un centre F ?! pfffff, je galère ! -

Vos photos de formations minérales encore en place, avant l'extraction.
Lionel-R a répondu à un sujet dans Forum Minéraux et Minéralogie
A priori fluo ou calcite ... ? -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
Je ne pense pas que tu dises n'importe quoi, tu observes les mêmes choses que moi, à savoir un défaut de coloration linéaire dont le nom est celui d'un défaut ponctuel qui de fait devrait être invisible, mais là attention tu fais une toute petite erreur d'appréciation. Les défauts sont ponctuels, ils sont donc invisible individuellement et là tu as parfaitement raison, mais si tu multiplies la quantité de défaut, tu peux "les rendre visibles". La quartz fumé, l'améthyste, fluorine verte, rose, violette, doivent leur couleur à des défauts ponctuels présents en grande quantité. La question la vraie, est s'il s'agit d'un vrai défaut de Frenkel, pourquoi semblent t'il suivre la direction [111] ? Il y a sans doute une raison toute bête... concentration de défaut dans la direction de croissance ?! Mode de croissance particulier qui permet de former une ligne de défauts de Frenkel ?! Franchement, pas la moindre idée... un cristallochimiste dans l'assemblée ? Et d'ailleurs comment sait on qu'il s'agit d'un défaut de Frenkel ? -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
Il n'y a aucune raison pour que ce défaut se répète, du moins, je n'ai jamais vu, lu, appris la moindre chose sur la répétition de ce défaut ponctuel, qui de fait n'est plus ponctuel... Du coup, je ne sais pas quoi te répondre et j'en suis autant désolé que frustré, je ne sais même pas où chercher ! -

Peyrebrune (Tarn) : ses mines et minéraux tel que fluorine
Lionel-R a répondu à un sujet de dani13 dans Forum Minéraux et Minéralogie
Merci :) Je pense que ça va être très difficile à photographier. Ça ressemble à une traînée verte qui suit la direction [111] et donc perpendiculaire aux plans (111). Pour voir des photos, il faut aller : Ici, puis ici, et là. Cette appellation me laisse très dubitatif, on me l'a toujours présenté comme un défaut ponctuel, or c'est très loin d'être le cas sur les photos, je serai ravi d'avoir des explications si quelqu'un en a.