Quelques-uns des principaux sujets de Géoforum

▲ Bourse minéraux et fossiles à PARIS ▲ |
-
Compteur de contenus
2618 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par Lionel-R
-

Collection d'Héloise 2
Lionel-R a répondu à un sujet de Prokofiev dans Demandes d' identification de minéraux
Ceci est une calcite d'une belle couleur :) Un test à HCl pour confirmer -

Le bore dans les silicates : petite question
Lionel-R a répondu à un sujet de greg la veine dans Forum Minéraux et Minéralogie
La question que tu poses est très délicates et requiert une expérience dans le domaine des silicates qui est à vrai dire un domaine particulier de la chimie minérale. Les borates sont aussi étudiés à part. Bref ce que tu demandes est très technique et c'est sans doute pour ça que tu n'as pas eu de réponse jusqu'à maintenant. Pour ta première question, j'ai envie de dire "pourquoi pas" les formules sont vraiment très proches ça ne me parait pas impossible, mais je n'en sais rien. La deuxième question est un peu plus dans mes cordes. Pour substituer un atome par un autre, il faut qu'il y ait une certaine ressemblance entre ces atomes. Les atomes doivent avoir des dimensions en fonction de la coordinence assez proches, des charges identiques si possible, et une ionocovalence de liaison proche. Enfin il faut des propriétés "électroniques" proches également. Pour éclairer tout ça je vais mettre quelques exemples. Le magnésium, le cobalt, le nickel et le zinc ont une taille proche quelque soit la coordinence, et se trouvent dans la nature à l'état divalent (le cobalt peut être rencontré à l'état trivalent). Ces trois éléments peuvent adopter des coordinences tétraédriques et octaédriques, aussi il n'est pas rare de les trouver tous en substitution les uns les autres : cobalt en substitution du magnésium dans les spinelles bleus (site tétraédrique), cobalt en substitution du zinc dans l'adamite rose (site octaédrique), cobalt en substitution du zinc dans la willémite bleue (site tétraédrique). Le cas des propriétés électroniques est à rapprocher des éléments comme le cuivre II et le manganèse III qui sont des cation dit Jahn-Teller : ils ont une grande préférence pour des environnement très distordus. Cela explique pourquoi les composés à base de cuivre II (Delafossite CuFe2O4) et de manganèse III (Haussmanite Mn3O4) n'ont pas de structure spinelle alors que cela est tout à fait possible. Maintenant on peut répondre à ta deuxième question. Le bore dans la nature est un cation trivalent qui se place au centre de triangles BO3 (borax) ou plus généralement d'octaèdres BO4 (borosilicate). C'est un atome très petit formant des liaisons très covalentes avec l'oxygène. Partant de là on peut imaginer substituer sans "trop" de difficultés du béryllium II, de l'aluminium III et du silicium IV au bore. Cependant le bore est vraiment petit et dans les borosilicates que j'ai pu regarder pour répondre à ta question, le bore occupe son propre site. C'est un cas différent de l'aluminium peut véritablement prendre la place du silicium dans une structure, les deux atomes occupant le même site : c'est une vraie substitution. Tu devrais regarder s'il n'y a pas des publications disponibles sur le sujet dans la revue American Mineralogist. Ta question est vraiment difficile et demande un savoir très spécialisé. N'aie pas peur de contacter un laboratoire de minéralogie, il y en a un sur Paris et plein sur le web. -
Pas sans test... ça peut être trop de chose... Un test de dureté et la couleur de poudre ou trace pour discriminer un peu
-

Les différentes formes du quartz
Lionel-R a répondu à un sujet de konny4031 dans Forum Minéraux et Minéralogie
Je me suis fait la même réflexion... C'est tout de même bizarre l'absence d'aluminium dans un quartz naturel (corrigez moi si je me trompe). Il y a encore plus étrange vu qu'il s'agit de cristaux hématoïdes, cela signale la présence de fer. Il devrait y en avoir quelque trace dans le quartz et or la pièce n'est pas améthysée. Tout les éléments sont présents : fer, radioactivité mais pas de coloration induite. La pièce aurait elle pu être chauffée "récemment" au delà de 250°C (disparition de la teinte fumé ou améthysée) ? La pièce a t'elle été trouvée à l'air libre ? Si oui on peut invoquer une améthyste photosensible qui se serait décolorée dans le temps à cause du soleil. A tout point de vu c'est une pièce particulièrement intéressante, en plus elle est agréable à regarder : de la belle minéralogie somme toute !!! -
Je ne suis pas convaincu par le vert... c'est plus pétant que ça. Epidote ? Diopside (pas certain) ? Zoizite ? Pas convaincu je ne vois pas de clivage. Bref pour moi c'est une couleur verte due au fer. Peut être un péridot ? (ça se trouve dans les pegmatites ?)
-

Minéralogie et minéraux de Lorraine
Lionel-R a répondu à un sujet de Théophraste dans Forum Minéraux et Minéralogie
Pas mal ça donne envie ! Les pièces sont trouvées comme ça ou il y a une bonne étape de nettoyage pour qu'elles soient aussi brillantes ? Belle découverte en tout cas. -

Vert / réaction UVL : vert
Lionel-R a répondu à un sujet dans Demandes d' identification de minéraux
Pas mieux.. je sèche -

Vert / réaction UVL : vert
Lionel-R a répondu à un sujet dans Demandes d' identification de minéraux
Ca sent le fer tout ça... rien ne me faisant penser au cuivre. Mais qu'est ce que tu as mis exactement dans le flacon ? tout en même temps, uniquement la croute, que des cristaux vert, que des blancs ? -
C'est simple à Bordeaux il n'y a rien... je n'aurai jamais cru qu'il puisse y avoir un tel désert minéralogique au moins en macro et je ne cache pas que je rêverai d'être contredit !!! En prospection j'ai dû gratter en tout trois jours dans l'aude, ça ne peut pas lutter avec mes 15 ans de volcanisme :) Pour revenir aux vidéos, ils sortent sur l'une d'entre elle un béryl au cœur gemme, pas trop moche et pour une fois il n'explose pas le bloc avec le marteau piqueur !!! Ici pour le béryl au cœur gemme Et là pour trois aigue-marine sympas de la même mine Ça reste des malades !!! ils cassent tout, je ne sais pas ce qu'ils cherchent (béryllium ?!), mais l'esthétique ne semble pas primer. Cela dit au Mont Micas, les exploitants n'y vont pas par quatre chemins c'est pas trop pourris (gemme, gros, coloration, minéraux rare...) mais y a pas mal de casse et de colle du coup !
-
De rien... j'ai regardé... bon... les béryl apprécient assez moyennement d'être sorti à la dynamite puis au marteau piqueur... c'est très pierreux je ne vais trop craché dans la soupe je n'ai jamais mis les pieds dans une pegmatite ça me changerait de mes coulées de lave et autre tuf :D
-
La Partie 3 est Ici
-

Vert / réaction UVL : vert
Lionel-R a répondu à un sujet dans Demandes d' identification de minéraux
Si tu fais un test acide essaie de séparer les grains blanc des vert et surtout cette plaque bizarre qui est très suspecte, on ne dirait pas quelque chose de naturel... -
Eh bien en Martinique, en Guadeloupe, il y en a beaucoup... le must c'est la Guyane il y en a PLEIN, regarde si tu ne peux pas en prendre là bas... après niveau écologique, faire venir de la terre de Guyane...
-
Ca serait moins dur si c'était iddingsitisée je pense. A la lumière du jour je ne sens plus le spinelle...
-

Vert / réaction UVL : vert
Lionel-R a répondu à un sujet dans Demandes d' identification de minéraux
Super colle... tu pourrais en dissoudre un peu dans l'acide et faire comme on a fait avant ? (dissolution et couleur, ajout de base : précipitation ? Couleur ?) et bien sur des photos à chaque étape. -
Je sens bien le spinnelle, la "pollution" est pas énorme tente une densité si possible ça donnera au moins une tendance
-

Altération et Minéraux secondaires
Lionel-R a répondu à un sujet de Augustin dans Forum Minéraux et Minéralogie
Ok... je mélange tout ... encore merci pour les lumières :) -

Altération et Minéraux secondaires
Lionel-R a répondu à un sujet de Augustin dans Forum Minéraux et Minéralogie
Je trouve que la frontière est mince : si un élément est remplacé par un autre c'est bien à cause d'une différence de solubilité. D'une part le fluide est pauvre en élément à remplacer d'autre part riche en élément remplaçant, on est dans un cas primaire d'altération par dissolution compliqué par le remplacement. Cela dit si un terme précis existe pour décrire tout cela c'est qu'il y a une raison bien précise, donc je suis tout à fait OK pour la distinction entre altération et métasomatose, dans ce sens merci pour l'éclaircissement. -

Altération et Minéraux secondaires
Lionel-R a répondu à un sujet de Augustin dans Forum Minéraux et Minéralogie
Je ne suis pas très compétent dans ce domaine à vrai dire je n'y connais rien. Vu que ta question tourne autour de la mobilité des éléments, je dirais que tout est une question de solubilité : la mobilité de l'élément va dépendre du pH, de la température et de la composition des solutions circulantes. En prenant le cas du cobalt provenant d'un skutérudite, il précipitera en présence de carbonate pour donner de la sphaérocobaltite (CoCO3). Le cobalt dissout précipite en milieu basique pour donner un hydroxyde de formule Co(OH)2 qui s'oxyde rapidement en hétérogénite CoOOH (avec un déshydratation partielle). Si l'hétérogénite ou le carbonate de cobalt sont portés à température, on obtiendra un spinelle de formule Co3O4 (je ne sais pas si on en trouve dans la nature...). En terme de loi général on peut aussi indiquer que la solubilité augmente avec la température et la pression. L'exemple est vraiment très rudimentaire mais à le mérite de fixer les idées, les choses doivent être d'un tout autre niveau dans la nature, l'exemple suffit au moins à fixer les idées et montre bien que l'on obtient des choses distinctes en fonction des conditions de températures (de pression) et de la composition chimique. Je ne suis pas certain d'avoir donner une réponse, mais dit simplement, il est sur que dans des conditions conduisant à une réaction chimique ou une précipitation, l'élément dissout n'ira pas très loin. En tout je ne peux pas aller plus loin, mes connaissances font défaut. Pour compléter l'altération, j'ai cru lire une fois que des fluides circulant enrichis en élément dissouts étaient à même de modifier la composition chimique des minéraux que le fluide rencontre. Ainsi on peut transformer des minéraux en d'autre. Dans ce ca peux t'on vraiment parler d'altération ? -

Aidez-moi à faire une sélection de gemmes
Lionel-R a répondu à un sujet de cascaillou dans Forum Minéraux et Minéralogie
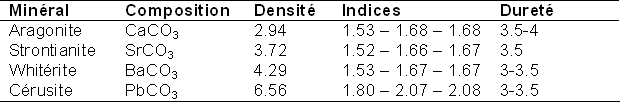
A vrai dire il n'y a pas de lien fort entre dureté et indice de réfraction... mais je n'aime pas les assertions sans explications. Un tout petit peu de théorie, très vulgarisée. D'après la loi de Gladston-Dale, il y a une dépendance linéaire entre l'indice de réfraction et la densité. Cette loi n'est valable que pour les gaz mais marche très bien pour les polymorphes du quartz. Cette loi stipule qu'à composition chimique égale plus un produit sera dense et plus son indice de réfraction sera important i.e. plus l'éclat tendra vers l'adamantin. On peut aller plus loin dans l'interprétation pour donner plus d'explications. L'indice de réfraction de la grande majorité des minéraux, ne dépend que de la "permittivité électrique" du minéral. Un mot bien barbare mais facilement explicable : la lumière est une onde électromagnétique, elle transporte donc une information électrique ET magnétique, or les atomes possèdent tous des électrons qui sont des charges et sont donc sensibles aux champs électriques. La permittivité électrique traduit la facilité de déformer le nuage d'électrons qui gravitent autour de l'atome. Plus ce nuage est déformable, plus la permittivité est grande et plus l'indice de réfraction est grand. Un atome dont le nuage électronique se déforme sous l'action d'un champ électrique est dit polarisable. La dureté est une affaire de liaisons chimiques. Pour un solide isotrope (système cubique) plus les liaisons seront covalentes et plus le solide sera dur. Par exemple un solide presque totalement ionique comme l'halite est très peu dur alors que le diamant qui est un composé extrêmement covalent (on ne peut pas faire mieux à vrai dire) est le plus dur tous. En intermédiaire on trouve les silicates qui doivent leur dureté aux tétraèdre de silicium qui sont particulièrement covalents. Dans les solides non isotropes, les choses se compliquent au niveau de la dureté car suivant les plans cristallins, les liaisons n'ont pas le même caractère ionique et covalent il s'en suit donc des duretés distinctes, un cas intéressant est celui du disthène avec des duretés allant de 5 à 7.5. Un cas extrême est celui des micas (ou du graphite, ou des argiles) ou les liaisons interplans sont faibles car ni covalentes ni ioniques... Le cristal peut être "découpé" avec l'ongle, c'est l'origine du clivage basal. Pour finir un exemple avec un tableau qui illustre bien un petit peu tout ce que l'on a vu : Le tableau précédent présente quatre carbonates isomorphes classés par densité croissante. On remarque que le passage de l'aragonite à la whitérite ne modifie pas les indices de réfraction cependant il y a légère diminution de la dureté que l'on peut attribuer à une augmentation de la ionicité de la liaison alcalin-terreux/oxygène. En effet les liaison calcium oxygène sont moins ioniques que les liaisons strontium oxygène, elles même moins ioniques que les liaison baryum oxygène. Ainsi on montre bien que la dureté n'est pas implicitement relié à la densité. Ces trois carbonates d'alcalino-terreux étant très ioniques et donc peut sujet à la déformation du nuage électronique c'est pour cela que les indices de réfraction ne bougent pas. Tout change quand on ajoute la cérusite, très dense (à cause du plomb) et avec un fort indice. Cela est dû au fait que le plomb est gros, le nuage électronique est donc très étendu d'où une grande sensibilité au champ électrique ce qui se traduit par une permittivité électrique forte et donc un plus grand indice. La dureté de la cérusite est pourtant équivalente à celle des trois autres carbonates précités. En résumé Pour avoir un minéraux durs il faut des liaisons fortes : des liaisons covalentes à très covalentes (Diamant, Moissantite, Corindon ...) Les matériaux à fort indices contiennent des atomes polarisables (Plomb, Soufre, ...) On pourrait aller plus loin et être encore plus rigoureux mais je pense que ça suffit largement pour fixer les idées. -

Pyramides blanches
Lionel-R a répondu à un sujet de Alpilles dans Demandes d' identification de minéraux
Je confirme sel d'alun : la forme des cristaux, le dépôt sur le doigt et la partie translucide juste dessous sont caractéristiques. -
Merci pour l'information ^^
-

Inclusion dans un quartz
Lionel-R a répondu à un sujet de JexSavoie dans Demandes d' identification de minéraux
J'appuie sur l'épidote également. -
Eh bien puisque l'on est sur la Namibie, je ne comprends pas pourquoi on ne voit jamais les minéraux associés aux améthystes d'Erongo. On y trouve de l'épidote, de la préhnite d'un vert éclatant, de l'analcime et de la calcite. Les pièces que j'ai pu voir ne sont pas très belles mais on doit pouvoir trouver des choses très bien alliant originalité et brillance... alors pourquoi n'en voit on pas ? j'ai mal cherché ?
-

Avec quoi nettoie-t-on nos minéraux ?
Lionel-R a répondu à un sujet de kaze dans Forum Minéraux et Minéralogie
Je trouve cet encroutement intéressant, il donne du contraste et du volume, S'il n'y a rien qui craint l'acide chlorhydrique, la goethite n'y résistera pas très longtemps.