Quelques-uns des principaux sujets de Géoforum
 ▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲ |

▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲
-
Compteur de contenus
1900 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par mr42
-
A part cet échantillon, tout est assez classique de ce type de gisement: du quartz, de la fluorine, de la barytine, des sulfures et divers produits de décomposition... Bien entendu, je pourrais tester tous les morceaux de barytine pour voir si ce n'est pas de la célestine... Quant au soufre, on trouve de nombreux fragments de fluorine jaune (plutôt jaune orangé pour la fluorine alors que là, on est plus près du citron que de l'orange). Peut être que du soufre s'y cache également. Mais là encore, il faudrait les essayer un par un. Les bonnes sources (dont geowiki) disent que les sulfures peuvent se décomposer en donnant du soufre. Est-ce une explication possible? ça semble trop massif pour être un produit de décomposition...
-
Voici donc la partie jaune. C'est aussi curieux mais d'une autre façon. Le spectre est pratiquement vide. Les quelques raies que l'on apperçoit doivent venir du graphite des électrodes, on les retrouve quasiment identiques lors d'un essai à blanc. On peut oublier la fluorine. J'en ai testées de plusieurs provenances, elles ont toujours réagi à ce type d'essai. J'avais testé divers métaux courants ou minéraux contenant des métaux. La plupart réagissent sans difficulté. Certains métaux comme le plomb sont plus difficiles à détecter. Il reste aussi de nombreux métaux exotiques que je n'ai pas sous la main. On peut quand même exclure la plupart des métaux courants. Un dernier essai plus classique: Un fragment du minéral jaune fond en quelques secondes à la flamme d'une bougie en donnant un liquide rougeâtre qui finit par brûler... Alors, un minéral jaune, pas très dur, qui fond facilement et ne contient probablement aucun métal... A part le soufre, que voyez-vous? La présence de soufre à cet endroit est quand même assez étonnante. Je suis retourné plusieurs fois sur place pour essayer de trouver d'autres échantillons similaires mais en vain. J'en arrive à me demander s'il n'aurait pas été prélevé sur une autre site puis abandonné là par un caillouteux distrait ou hésitant...
-
Je n'ai pas essayé le test de flamme mais je peux dire que l'arc électrique a bien une couleur rouge. Je ferais bien l'essai à la flamme mais je n'ai pas de grosses quantités d'échantillon. J'avais fait des comparatifs sur d'autres minéraux, la flamme donne généralement un spectre qui n'est qu'une version floue du spectre d'arc électrique. Pour le jaune, j'y arrive.
-
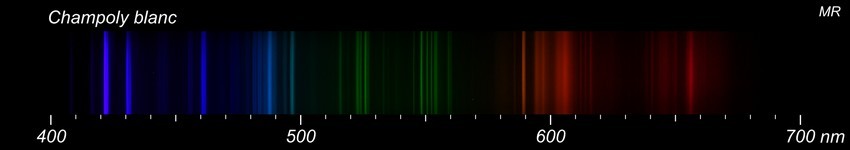
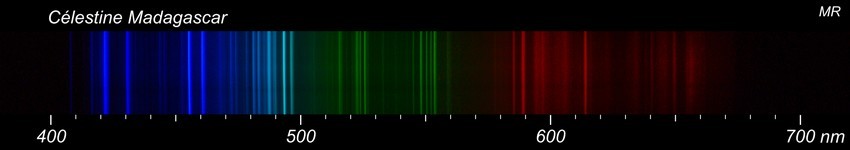
Depuis quelque temps, je me suis lancé dans des essais de spectrographie. Voir: http://www.geoforum.fr/topic/25445-spectrographie-et-identification-des-mineraux/?hl=spectrographie Je prélève un petit fragment que je pulvérise et que je soumets à un arc électrique. La lumière de l'arc est analysée par un spectroscope et captée par un appareil photo. Tout le matériel est de ma fabrication (à part l'APN) donc assez limité. J'en ai donc profité pour réexaminer cet échantillon et là, j'ai eu quelques surprises. D'abord, le spectre du minéral blanc supposé être de la barytine. Le spectre contient bien quelques raies du baryum mais elles restent peu intenses. J'ai mis pour comparaison les spectres d'une barytine de Marsange et d'une célestine de Madagascar. On est nettement plus près de la célestine que de la barytine... Pas évident de conclure, les essais sont qualitatifs et je ne suis pas un expert mais quand même, il faut bien reconnaître qu'il y a du strontium dans cet échantillon et que le baryum est assez discret. A ma connaissance, la célestine n'a jamais été signalée à Champoly alors que la barytine y est abondante...
-
Une zone très réduite fait effervescence avec HCl. Sinon, pas de réaction.
-
Bonsoir, j'ouvre ce sujet dans la rubrique demandes d'identification mais en fait je pense avoir la réponse. Comme elle est (pour moi) assez inattendue, j'aimerais avoir des avis éclairés aussi bien sur le résultat que sur la méthode. Merci d'avance. Voilà, il s'agit d'un caillou que j'ai ramassé il y a de nombreuses années à Champoly (42) sur les haldes d'une ancienne mine de plomb et d'argent. Il comprend principalement deux minéraux, l'un d'un blanc très pur, parfois transparent (à moins que ce ne soient deux espèces différentes?) l'autre est jaune. A l'époque, avec des moyens limités, j'avais conclu à une association de barytine et de fluorine. Ce sont deux minéraux habituels de l'endroit, la fluorine est souvent dans les jaunes. Les cristaux blancs sont très allongés et disposés en éventail. Le minéral jaune ne présente pas de forme cristalline identifiable. La dureté semblait coller bien que, pour la partie jaune, le minéral soit trop friable pour faire une mesure précise. La densité est délicate à évaluer du fait de la présence de plusieurs cavités et difficile à interpréter pour un échantilon composite. J'en étais resté là avec des doutes sur la partie jaune.
-

Vos belles photos de chutes d'eau
mr42 a répondu à un sujet de LISA dans Y'a pas que les Sciences de la Terre dans la vie...
Hraunfossar en Islande, une résurgence dans un champ de lave. Désolé pour la qualité de la photo prise sous la pluie. -

Vos découvertes de minéraux les plus récentes (2) !
mr42 a répondu à un sujet de le sablais dans Forum Minéraux et Minéralogie
C'est une belle découverte mais c'est quand même curieux. Tous ces cristaux aussi nets sur un terrain qui est labouré chaque année (et depuis quand ?) Même si le quartz est dur, ils devraient être beaucoup plus usés. N'auraient-ils pas pu être déposés ici par l'homme pour une raison qui reste à déterminer ? Maurice -
Juste pour compléter la réponse de Serge. La rhéologie ne concerne pas que la géologie. C'est l'étude des déformations sous l'effet d'une contrainte. On l'utilise beaucoup en métallurgie pour toutes sortes de transformations par déformation plastique: comment se déforme un bout de métal écrasé par une presse ou une tôle dans un laminoir... Elle doit intervenir dans de nombreux autres domaines.
-

Un astéroïde va frôler la Terre vendredi prochain
mr42 a répondu à un sujet de ipadje dans Météorites
Une grande et affligeante nouvelle: Les "journalistes scientifiques" de CNN se demandent si la trajectoire de l'astéroïde aurait pu être modifiée par le réchauffement climatique! http://bigbrowser.blog.lemonde.fr/2013/02/15/crash-cnn-se-demande-si-le-frolement-de-lasteroide-avec-la-terre-est-du-au-rechauffement-climatique/ -
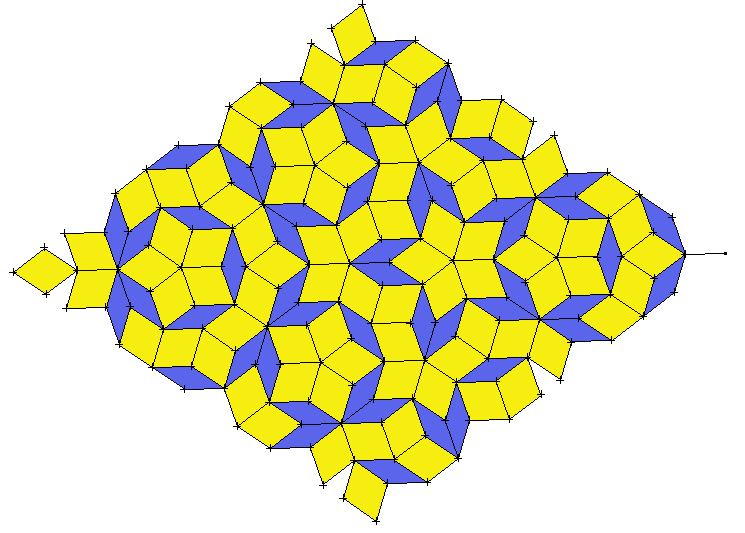
Pour comprendre les quasi-cristaux, le plus facile est de partir de la géométrie. On sait depuis longtemps couvrir un plan en répétant à l'identique un même motif tel qu'un carré pour obtenir un damier, un hexagone pour obtenir un pavage en nid d'abeille, etc... Selon le motif de départ, on peut obtenir un pavage à 2, 3, 4 ou 6 axes de symétrie. On sait en revanche qu'un pavage à 5 axes de symétrie en répétant une seule et même figure telle qu'un pentagone est impossible. Pourtant, vers 1970, le mathématicien anglais Robert Penrose a présenté un pavage avec non plus un seul motif mais deux motifs de base qui imite une symétrie d'ordre 5. Sur la figure jointe, on peut voir un tel pavage en répétant deux losanges avec des angles aigus de 36 et 72 degrés. Mais contrairement aux pavages classiques, les pavages de Penrose ne sont pas périodiques. Voir : http://fr.wikipedia.org/wiki/Pavage_de_Penrose Quelques années plus tard, le physicien Daniel Shechtman a découvert que certains solides diffractaient les rayons X comme s'ils présentaient une symétrie d'ordre 5 ou 10. Ces solides étaient en fait organisés un peu comme des pavages de Penrose à 3 dimensions. Ces solides diffractent les rayons X comme des cristaux mais ne répondent pas à la définition classique des cristaux dans la mesure où les atomes de sont pas disposés de façon périodique. Il a donc été décidé de leur attribuer le nom générique de quasi-cristaux. Depuis, les découvertes de nouveaux quasi-cristaux se sont multipliées. Il me semble cependant que la plupart des quasi-cristaux trouvés jusqu'à ce jour sont de taille microscopique.
-

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Après tous ces essais, un essai de bilan. Les deux points importants me semblent être : qu'on peut obtenir des infos qualitatives sur la composition chimique des minéraux sans employer de moyens lourds, que ces essais ne nécessitent que de petits échantillons, l'équivalent d'un grain de riz. Lors de ces essais, j'ai pu identifier avec plus ou moins de difficultés une quinzaine de métaux différents ainsi que l'hydrogène. Les autres éléments non métalliques restent par contre sans réaction. Quelques liaisons moléculaires apparaissent également avec le graphite et la fluorine. Parmi les métaux, il y a une différence entre : ceux qui produisent un nombre limité de raies de forte intensité (Ca, Ba, Sr, Cu, Zn, Hg...) les plus faciles à identifier, ceux qui produisent un spectre particulièrement fourni duquel rien n'émerge vraiment comme Fe ou W qui demanderaient une meilleure résolution, les grands timides comme Pb ou Sb qui risquent de passer inaperçus, une extension vers l'ultraviolet devrait améliorer les résultats. Cela reste qualitatif, on est loin de pouvoir passer au stade quantitatif. Il faudrait d'abord arriver à des résultats plus reproductibles. De plus, les éléments réagissent différemment selon les composés dans lesquels ils sont insérés. La meilleure façon d'utiliser cette technique me semble être la constitution d'une bibliothèque de spectres des espèces minérales à partir d'échantillons bien validés. Quelques pistes pour progresser : pouvoir traiter des minéraux plus durs, notamment les silicates (est-ce que le silicium réagit?) améliorer la résolution du spectroscope permettrait de mieux voir les éléments avec un grand nombre de raies comme le fer, étendre le spectre hors de la lumière visible, l'UV pour voir davantage de raies atomiques et l'IR pour les liaisons interatomiques... -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
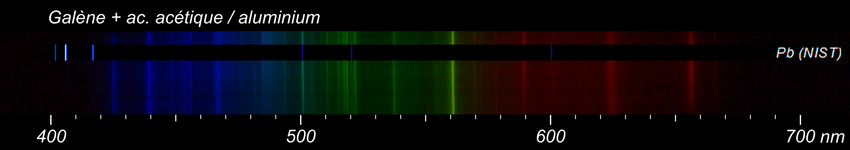
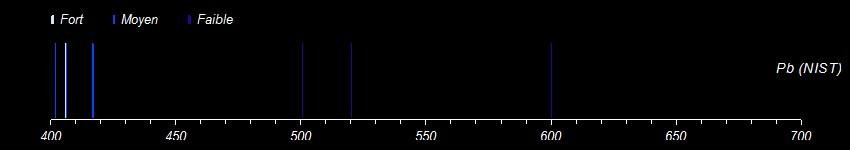
Un problème diamétralement opposé au précédent. Il s'agit de galène. Il y avait tellement peu de résultats avec les électrodes en graphite que je les ai remplacées par de l'aluminium. Il y a plus de raies parasites mais curieusement, on distingue 2 raies du plomb vers 500, 520 nm. Enfin j'espère que c'est bien lui. Ici le problème confirmé par NIST, c'est que dans le visible les raies du plomb ne sont ni très intenses ni très nombreuses. Les plus intéressantes se trouvent à la limite de l'ultra-violet, là où mon appareil ne voit plus rien. Il sera de toute façon difficile de reconnaître le plomb sauf à étendre le champ de vision dans l'UV. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
La pyrite, j'y ai pensé mais c'est un peu trop dur pour mes outils. Je essayer une nouvelle fois, voir si j'arrive à la broyer correctement... Et puis, dans un acier à ferrer les ânes (des clous achetés chez bricomerlin) il n'y a quand même pas tant d'additifs que ça. Le chrome, le vanadium, etc.. ça coûte. De toute façon, les trucs compliqués, c'est bien ce qu'on rencontre dans la vraie vie. Il faut y aller progressivement mais y aller quand même. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
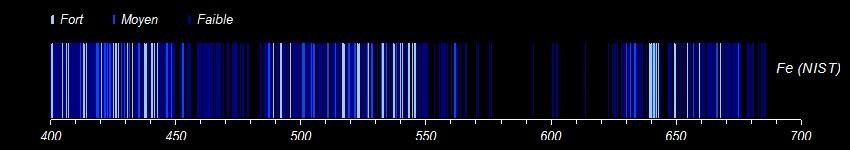
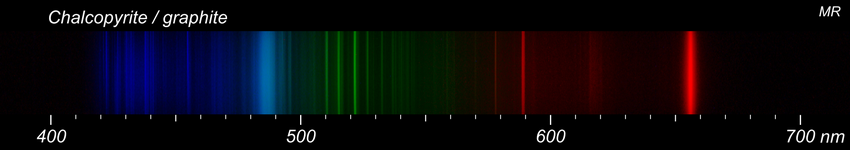
La base de données du NIST est un outil remarquable mais pas très facile à utiliser surtout quand on n'est pas spécialiste. Concernant le fer, elle propose plus de 2000 raies rien que dans le visible. Il y a des indications telles qu'intensité relative ou probabilité de transition qui permettent de faire un tri mais ça débouche rarement sur une coïncidence parfaite avec les données expérimentales. Pour aller plus loin, voici un extrait de la base pour le fer sous forme graphique. J'ai séparé un peu arbitrairement les raies selon leur intensité relative en fort, moyen et faible. On retrouve alors un air de famille avec le spectre de l'acier. La plage 485-580 correspond assez bien. Dans le spectre que j'ai obtenu, les rouges extrêmes et les violets sont filtrés par l'appareil photo. Il y a en revanche plusieurs raies dans la plage 580-630 qui sont quasiment absentes chez NIST. Peut-être une addition ou une impureté dans l'acier? Certaines parties se retrouvent également dans la chalcopyrite du message précédent là où elles ne sont pas masquées par d'autres éléments. Quelqu'un a-t-il déjà utilisé ces tables? -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
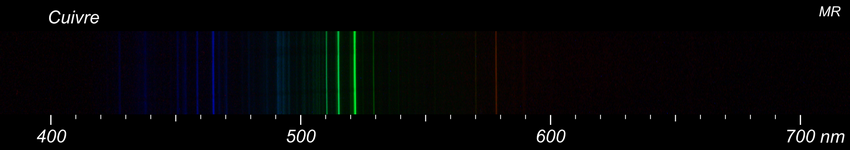
Quelque chose de plus compliqué avec une chalcopyrite. Pour comparaison, les spectres du cuivre et d'un bout d'acier censé représenter le fer. Il s'agit d'objets d'usage courant dont la composition n'est pas garantie. Le cuivre est assez facile à identifier dans le spectre de la chalcopyrite : un petit nombre de raies très lumineuses domine le reste. Pour le fer, c'est un autre histoire. De nombreuses raies dont aucune ne domine vraiment. Il n'est pas facile d'être certain de la présence de fer. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
-

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Bonsoir Zunyite, Pour moi, c'est plutôt un coup de lime, l'une des électrodes est plate. A part le taille-crayon, je suppose que le reste de l'apapreil était plutôt professionnel? -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Le graphite, c'est bien le blanc dont tu parles. J'ai deux électrodes en graphite et sur l'une d'elles, je pose l'échantillon à tester. Le blanc, c'est le graphite sans rien dessus comme dans le message 30. Après, il faut bien comprendre que ce n'est qu'un bricolage avec des moyens réduits. La reproductibilité est difficile à maîtriser : Il faudrait vérifier la charge du condensateur avec plus de précision. Les électrodes sont rapidement polluées par les échantillons, il faut les nettoyer et les poncer régulièrement, ce qui fait que leur forme et leur position varie d'un essai à l'autre... Il reste beaucoup de chose à améliorer mais si je regarde le chemin parcouru depuis mes premiers essais, on peut toujours rêver... -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Merci -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Voici le spectre du graphite qui sert de support à la plupart des essais. Il s'agit pour une fois d'un produit relativement pur acheté au dernier salon des minéraux de Paris. Si le vendeur se reconnaît, il verra combien son produit m'a été utile... Comme pour la fluorine, j'ai pu trouver un point de comparaison avec un cours de combustion de Giorgio Zizak, CNR-TEMPE, Milan : http://www.tempe.mi.cnr.it/zizak/tutorial/cairol06-flame-emission.pdf Le deuxième graphique est extrait de ce cours. Il s'agit d'un spectre d'émission d'une flamme de méthane. Le premier et le troisième viennent de mes essais. On retrouve les raies de Swan (je viens d'apprendre leur existence) qui sont émises par des molécules C2. Maurice -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
C'est bien, vous vous souciez tous les deux de sécurité. De mon point de vue, il n'y a qu'une seule et même réponse à vos deux préoccupations : en dire le moins possible. Zunyite, je te suis tout à fait, j'ai pris quelques précautions : j'ai exclu dès le départ le courant alternatif et j'ai cherché à utiliser la tension la plus basse possible. La capacité du condensateur et le niveau de tension font que l'on doit rester dans la zone non dommageable (intensité et durée de décharge) définie par la norme CEI 479-1. Ces calculs n'engagent que moi. J'aurais aimé partager mais je préfère attendre d'avoir trouvé mieux. Par contre, si un jour je trouve une solution bisounours, alors je suis les conseils de Next et je dépose un brevet. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Je me disais bien que tout ça avait un air de famille. Non, en fait je suis tombé dessus sans le faire exprès en cherchant des spectres de fluorine sur google. Je crois que tu es du coté de Bordeaux, c'est un peu loin, mais si un jour tu passes par Paris, fais moi signe en MP, je te montrerai comment ça marche. C'est difficile de tout expliquer par correspondance. Les matériaux purs, oui, c'est une des difficultés. En même temps ça oblige à se poser plein de questions et c'est plutôt une source de progrès. Cela dit, je fais tout ça par curiosité, pour comprendre. Il n'y a pour moi aucun autre enjeu, aucune obligation de publication. Il y a de toute façon des labos pour lesquels tout ça est trivial.. Pour l'intensité des raies, ça reste sommaire. Je pars du fichier image dans lequel une macro va lire les composantes RVB de chaque pixel et je fais une moyenne sur la plage concernée. Le sens de ce signal n'est pas évident dans la mesure où il dépend entre autres du fonctionnement de l'appareil photo. Le temps de pose est imposé par la décharge du condensateur, je peux moduler la charge du condensateur via la tension mais je ne connais pas réellement le temps de décharge qui est très bref, une fraction de seconde. Je fixe le temps de pose de l'appareil à 2 ou 3 secondes pour être certain de capter le bon moment. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
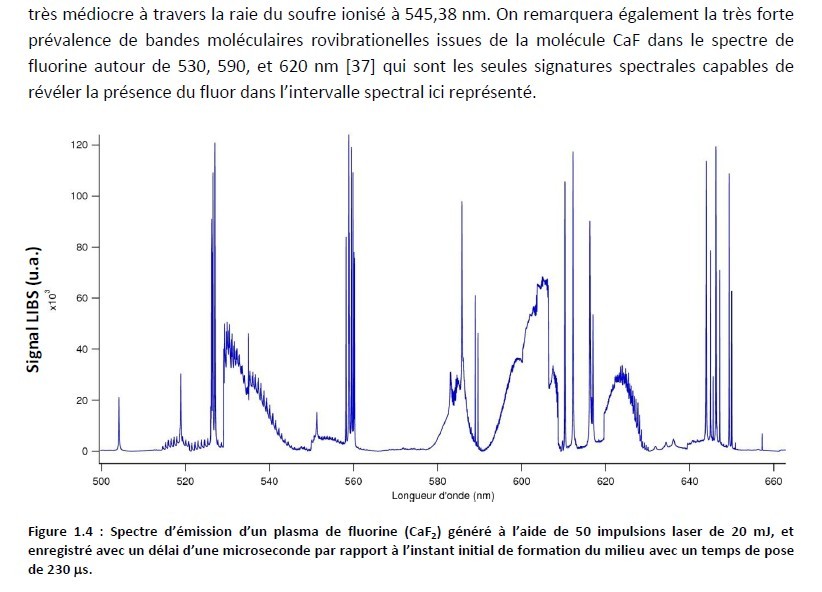
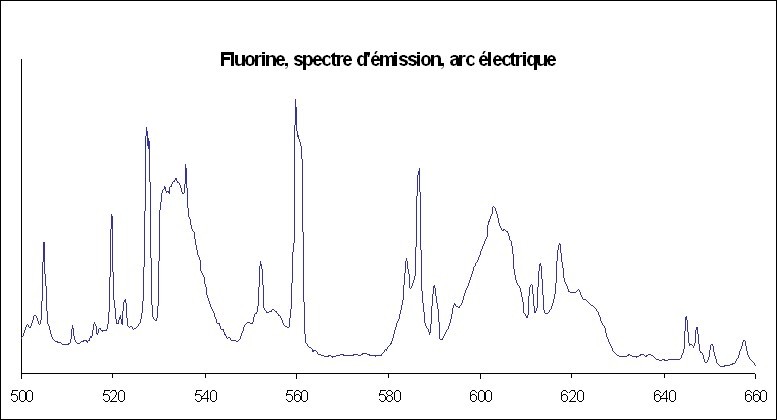
Un rectificatif à mon précédent message. En fouillant sur le net, j'ai trouvé une thèse intéressante que certains d'entre vous connaissent peut-être. On y trouve en particulier un spectre d'émission de fluorine. Sur l'extrait ci-joint, on voit que la fluorine présente plusieurs bandes continues d'émission caractéristiques. J'ai essayé de reproduire ce diagramme à partir de mes propres données (photo du message 23). Même si le procédé est différent (plasma induit par laser dans le cadre de la thèse) et si la qualité n'est pas la même, on retrouve bien les mêmes bandes pour les mêmes longueurs d'ondes. Si le fluor n'apparaît pas directement, il y a bien dans le spectre des éléments caractéristiques de la fluorine. Sur les 3 bandes citées, deux ne se retrouvent ni dans la calcite, ni dans le gypse. Référence : Spectroscopie LIBS sans calibration : évaluation critique et application à l’analyse de sols pollués par Grégoire Travaillé. Thèse de doctorat en Sciences physiques et de l’ingénieur. Physique des plasmas Sous la direction de Lionel Canioni. Soutenue le 22-11-2010 à Bordeaux 1, dans le cadre de École doctorale des Sciences physiques et de l’Ingénieur (Bordeaux). -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
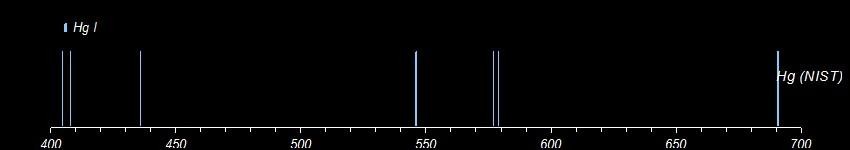
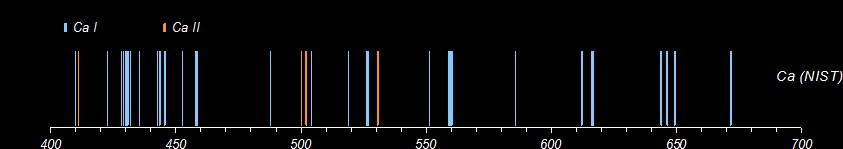
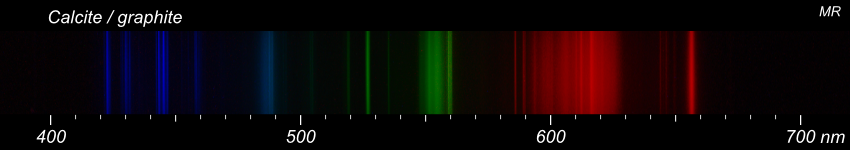
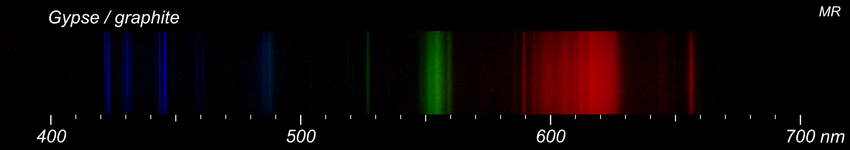
On ne peut pas non plus tout détecter. Voici 3 essais sur de la fluorine, de la calcite et du gypse. Pour comparaison, les données du NIST pour le calcium. La présence de calcium est clairement confirmée dans les 3 échantillons. Par contre, je ne vois pas comment distinguer les fluorures des carbonates ou des sulfates.