Quelques-uns des principaux sujets de Géoforum
 ▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲ |

▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲
-
Compteur de contenus
1900 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par mr42
-
On sent une certaine nostalgie, JLOUI… Cette discussion était pourtant partie sur des bases intéressantes, un objet bien réel, une question légitime et des moyens d’analyse pertinents et finalement, on se retrouve dans la même situation, on ne fait que répéter les mêmes échanges sans espoir de converger. Tout a été dit et les conclusions sont nettes, on ne progressera plus. Notre ami romt20 a quand même eu le mérite de nous pousser à faire le point sur nos connaissances. Beaucoup d’éléments intéressants ont été mis sur la table et ils seront utiles pour de futures discussions. Si on veut les sauver, il vaut mieux arrêter de les noyer dans une dialectique sans issue et parfois, comme le souligne le sablais, à peine compréhensible.
-
Un document de l’université de Limoges à propos de la mine et de l'usine de traitement de minerai d’antimoine d’Ouche dans le Cantal. Il y a aussi des résidus métallurgiques mais ils sont très différents de ceux dont nous parlons ici, la silice est très largement majoritaire. Il y a quand même deux points intéressants. D’abord la troïlite est présente dans les résidus métallurgiques d’extraction d’antimoine. Ensuite l’étude souligne qu’il reste très peu de ces résidus sur le site, ils ont été utilisés pour empierrer les routes de la région. Cette mine a du fermer vers 1970 et à l’époque, on n’hésitait pas à disperser les résidus dans la nature. Si vous chassez les météorites du côté de Massiac, attendez-vous à une bonne récolte de scories à troïlite… http://www.unilim.fr/sermiel-dev/wp-content/uploads/sites/5/2014/06/Courtin-Nomade-et-al.-2012.pdf
-
Une dernière tentative d’explication.Je ne sais pas si ce sont des météorites ou autre chose encore mais je veux au moins montrer qu’il n’y a pas d’objection majeure à ce que ces cailloux soient des résidus métallurgiques d’extraction de plomb ou de cuivre. La teneur en zinc n’a rien d’anormal. Quand on extrait du plomb ou du cuivre, le zinc est un déchet : le zinc contenu dans le minerai se retrouve principalement dans les scories. S’il y a beaucoup de zinc dans les scories, ça veut simplement dire que le minerai contenait beaucoup de zinc ce qui est le cas de nombreux minerais sulfurés. Extraire simultanément le zinc et le plomb est compliqué, c’est possible avec certains procédés récents mais ils sont peu répandus. Depuis le début, je répète que ce n’est pas un résidu de la métallurgie du zinc. A l’usine de Noyelles-Godault qui produisait du plomb et du zinc, les « scories de plomb » étaient plus riches en zinc que les « scories de zinc ». Dans certaines usines, les scories de plomb sont même utilisées comme minerai de zinc. La teneur en soufre est élevée sans être extravagante. L’activité chimique du soufre fait partie des paramètres fondamentaux du procédé mais elle n’est pas si simple à régler : il est impossible de laisser une sonde de mesure en permanence à une telle température et dans un tel milieu. Pour un même haut-fourneau la teneur en soufre varie de façon importante d’une coulée à l’autre. Pour une valeur cible autour de 1 à 2 %, on ne peut pas éviter des excursions à plus de 3 %. Obtenir 3,5 % de soufre n’est sans doute pas optimal mais tout à fait réalisable. Tant que le soufre est piégé par le zinc, ça n’empêche pas d’extraire un maximum de plomb. Un dernier commentaire sur l’aspect des scories : elles sont extraites à l’état liquide et il existe plusieurs façons de les refroidir. Elles peuvent être versées dans une fosse où elles se refroidissent à l’air en masse compacte. On doit alors être alors proche des conditions de refroidissement d’une coulée de lave. On peut aussi vouloir obtenir des résidus sous forme de granulats et pour cela on utilise un refroidissement plus énergique avec de l’eau. C’est plus coûteux mais on peut les valoriser plus facilement. Dans le cas présent, c’est évidemment à la première solution qu’il faut s’intéresser.
-

Minérai à identifier
mr42 a répondu à un sujet de rodgers dans Demandes d' identification de minéraux
En ce qui concerne mon échantillon qui ressemble beaucoup à celui de Rodgers, je pense qu’il y a bien de la chalcopyrite : le spectrographe indique la présence de fer et de cuivre et l’odeur d’H2S avec l’acide chlorhydrique me fait dire que c’est un sulfure. C’est vrai que l’aspect n’est pas uniforme, il pourrait s’agir d’une association de pyrite et de chalcopyrite. -

Minérai à identifier
mr42 a répondu à un sujet de rodgers dans Demandes d' identification de minéraux
Bonjour, j’ai ramené d’un voyage à Potosi quelque chose qui ressemble beaucoup. C’est de la chalcopyrite avec un peu de sphalérite (gris foncé). Il y en a plein, il suffit de se baisser pour en ramasser. -
C’est un phénomène assez répandu, il ne concerne pas que la chalcopyrite. Voici un autre exemple avec un impact d’arc électrique sur un acier inoxydable : Ces couleurs sont produites par l’interférence de la lumière avec une fine couche transparente. Dans le cas des aciers il s’agit d’oxydes normalement opaques mais qui deviennent transparents en faible épaisseur. Dans le cas de la chalcopyrite, je n’en sais pas plus, il pourrait aussi s’agir d’oxydes... La couche en question doit être très mince (quelques microns) et n’affecte que la surface. Il semblerait que certaines chalcopyrites aient été traitées artificiellement pour produire ces mêmes couleurs : https://www.mindat.org/forum.php?read,19,28717,96921
-
Bien romt20, vous voilà devenu expert en résidus métallurgiques. Il faudrait peut-être commencer par apprendre la différence entre un chlorure et un chlorate, à ne pas confondre zinc et sulfure de zinc…
-
Voir la référence ci-dessous : les résidus d’extraction de cuivre de Penn Mine contiennent jusqu’à 28 % de zinc. Nos 12,55 % de Zn sont finalement assez minables. https://web.stanford.edu/dept/news/pr/98/981209slag.html
-
Ces textures ne me disent pas grand chose. Il sera difficile de trouver des images analogues concernant des résidus. Qu’il s’agisse d’une lave ou d’un résidu, les conditions de refroidissement ne sont pas très différentes, il serait normal que l’on retrouve des points communs. Le fer sans magnésium peut venir de pyrites (minerai, charbon?) mais vu la quantité, il est plus probable qu'il a été introduit sous forme métallique. J'avais quelques données sur les résidus de pyrites grillées de Chessy, les teneurs en soufre sont assez élevées. Les proportions ZnS/ZnO ont du se régler lors du grillage qui est une réaction solide-gaz avec une cinétique pas évidente. Je reste sur l’hypothèse d’un procédé métallurgique en deux phases : grillage puis réduction. Les conditions de fonctionnement de l’opération finale (la fin de la réduction en haut-fourneau) sont assez claires : - la température devait être suffisante pour fondre l’essentiel des minéraux en présence, typiquement 1200 à 1300°C. - le potentiel chimique en oxygène devait correspondre en gros à l’équilibre CO<>CO2 ce qui permet de placer le point de fonctionnement sur le diagramme d’Ellingham des oxydes. La réduction n’a pas été poussée très loin, FeO et ZnO sont encore stables mais ça suffit pour réduire les oxydes de plomb et de cuivre. Les oxydes de Si, Ca, Al, etc. sont hors de portée. - la présence simultanée de cuivre métallique et de sulfure de cuivre permet également de fixer le potentiel chimique en soufre au niveau de l’équilibre Cu2S<>Cu sur le diagramme des sulfures. On voit que les sulfures de plomb et de fer sont décomposés mais que ZnS peut survivre. Ces 3 paramètres (température, potentiels chimiques en S et O) sont ceux qu’on aurait choisis pour récupérer un maximum de plomb ou de cuivre à l’état métallique. La composition (qui reste à compléter) est à ce stade tout à fait logique pour un résidu métallurgique d’extraction de plomb ou de cuivre. Ou alors c’est une météorite qui imite à la perfection un résidu métallurgique.
-
Ça avance ! Merci romt20 mais il ne faudrait pas donner les résultats sous forme de feuilleton, façon canard enchaîné. Il doit bien y avoir quelques explications avec l’analyse... Est-ce que l’analyse a donné d’autres éléments ? On ne parle plus de cuivre, plomb, chlore, baryum… Au total, on n’arrive qu’à 80 %. Il y a de la place pour d’autres trucs. Comment est compté l’oxygène ? Si, Al, K sont présentés sous forme d’oxydes mais pas Fe, Ca, Zn…
-
Bonjour, Les lampes UV à LED existent avec plusieurs longueurs d’onde. Les lampes UV classiques au mercure présentent un pic à 365 nm. Je dispose de deux lampes UV longs, une au mercure et une LED avec un maximum vers 390 nm. Sur certains minéraux (rubis, calcites…) la fluorescence est bien visible avec les deux types de lampes. Sur d’autres minéraux, il peut y avoir des différences importantes : j’ai des cérusites qui ne réagissent pratiquement pas avec la LED 390nm alors que la fluorescence est nette avec la lampe au mercure. Je pense qu’une lampe UV à LED à 365 nm doit être équivalente à une lampe UV au mercure mais je n’ai pas essayé.
-
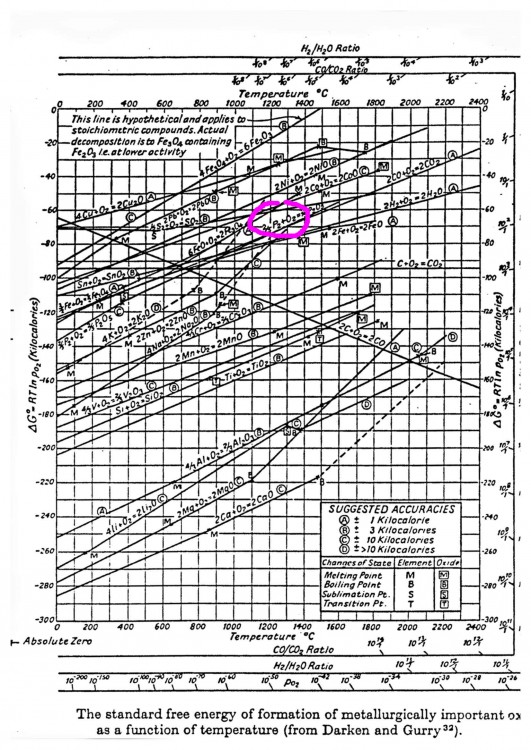
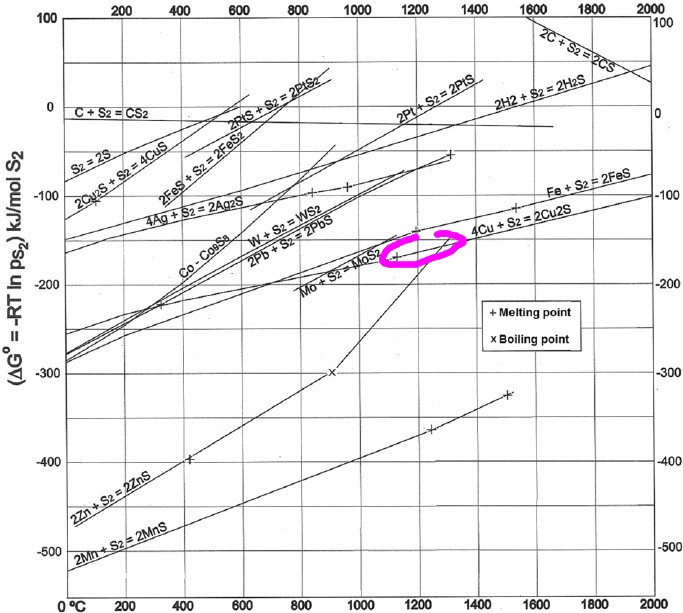
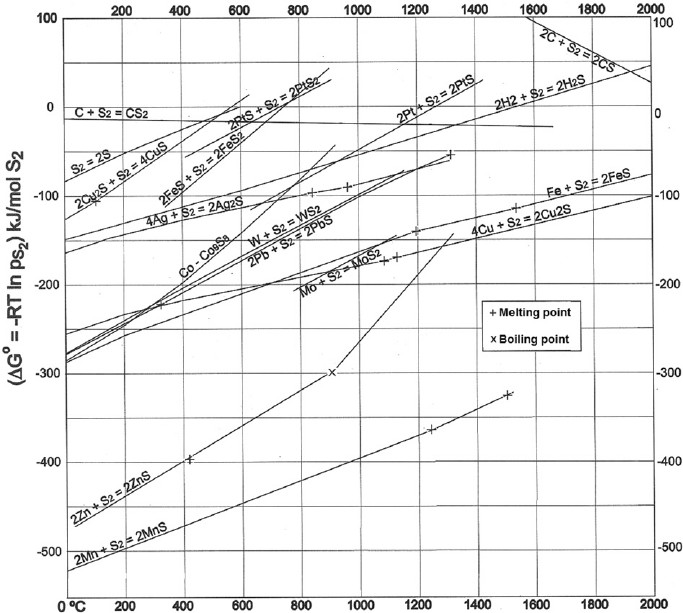
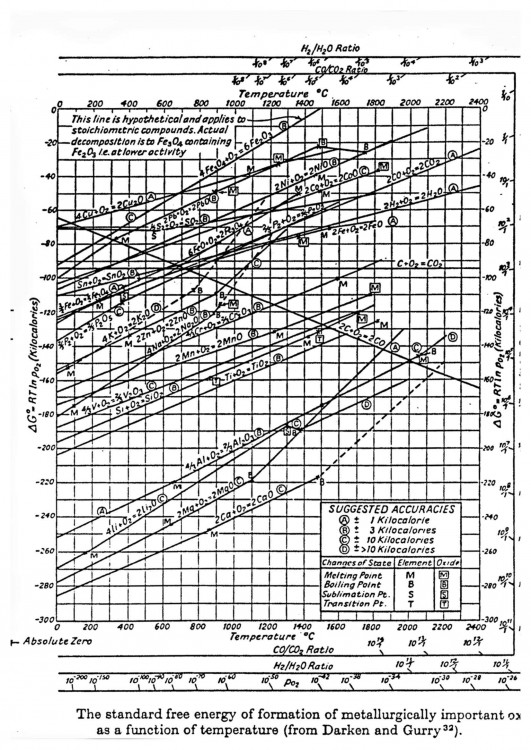
Pour illustrer les explications de Dabo, voici un diagramme d'Ellingham relatif aux sulfures. Ce diagramme permet de comparer la stabilité de divers sulfures. Il confirme que la galène peut être désulfurée à haute température par le cuivre et le fer avec formation de pyrrhotite ou de troilite pour ce dernier. Le sulfure de zinc encore plus stable pourrait convenir mais l'ébullition du métal vers 900°C rend l'opération impraticable. On retrouve tout en bas le manganèse dont le sulfure est particulièrement stable. Le manganèse peut être ajouté aux aciers pour diverses raisons et en particulier pour fixer le soufre: MnS est mécaniquement moins gênant que FeS. https://www.researchgate.net/figure/269392736_fig7_Fig-7-Ellingham-diagram-for-some-metal-sulphides-variation-of-Gibbs-free-energy-of La métallurgie du plomb reste néanmoins essentiellement basée sur un grillage suivi d'une réduction en haut-fourneau. Si l'objet de cette discussion est un résidu de métallurgie extractive, alors il s'agit d'un résidu de réduction et non de grillage. Il faut donc se tourner vers le diagramme d'Ellingham des oxydes: http://www.skuola.net/universita/media-file/4a3612ced4141572a1548ce96741ecf3/preview/1 Sur le diagramme d'Ellingham des oxydes, on doit se trouver quelque part entre FeO et PbO/Cu2O, dans des conditions modérément réductrices, le tout à une température suffisante pour fondre tous ces matériaux. La composition est alors très logique : Cu se retrouve à l'état métallique ou sous forme de sulfures mais pas d'oxydes. Pb se retrouve à l'état métallique (ou sous forme de chlorures ce qui est plus original) mais pas d'oxydes ni de sulfures. Zn à l'état de sulfures ou d'oxydes éventuellement englobés dans des silicates mais pas de Zn métal qui de toute façon se serait évaporé. Fe ressort à l'état d'oxyde FeO libre ou embarqué dans des silicates. Noter que FeO libre n'est pas stable à température ambiante et devrait se décomposer en Fe+Fe3O4 lors du refroidissement ce qui expliquerait le magnétisme observé par romt20. Ca, Si ne peuvent pas être réduits et se retrouvent dans des silicates. L'objet a du passer par un état entièrement fondu dans des conditions moyennement réductrices à haute température et sous une pression peu élevée. Ces diagrammes ne permettent pas de dire si ces conditions ont été obtenues dans un réacteur métallurgique ou quelque part dans l'univers. Les lois de la physique et de la chimie sont universelles, le même mélange fondu dans les mêmes conditions donne après solidification les mêmes minéraux. Seule la vitesse de refroidissement peut éventuellement conduire à des espèces hors d'équilibre.
-
Comme la quille en uranium appauvri d'Alain Colas. Dabo, romr20, je vous vois venir, vous allez me dire que je passe du plomb à l'uranium... A tout prendre, il vaut mieux péter le premier.
-
A ce stade de la discussion, je n'ai pas vu un seul argument solide montrant que ce n'est pas un résidu de la métallurgie du plomb. Je ne suis pas certain qu'il s'agisse d'un résidu métallurgique mais si c'en est un, le plomb et le cuivre sont les plus probables. Le fer est éliminé et le zinc probablement.
-
S'il se confirme qu'il y a beaucoup de fer, il faudra plutôt regarder du côté de la métallurgie du cuivre, comme suggéré par jjnom, le traitement de la chalcopyrite expliquerait mieux la composition. Mais à ce jour, nous n'avons pas d'analyse globale. Difficile de dire qu'il y a trop de ceci ou pas assez de cela. D'autre part, la galène est souvent accompagnée par la chalcopyrite. Au contraire, ça coûte de les stocker. Plus on en "perd", plus on est content Il n'y a pas si longtemps, on les utilisait pour toutes sortes de remblais sans se soucier de l'environnement. Les résidus industriels se sont largement disséminés dans la nature.
-
S'il vous plait, arrêtez de rabacher cet argument bidon. Il existe des tas de résidus avec des sulfures. Avec autant d'obstination et aussi peu de rigueur, vous arriverez inévitablement à la conclusion que vous espérez. Pas besoin d'analyses. 100% d'accord avec Géologiste.
-
Il existe des tas de sortes de résidus, ils sont aussi variés que les roches de la terre. Qui oserait dire qu'il les connaît tous? J'en ai vu plusieurs sortes mais je suis loin d'être un expert. A ma connaissance, les seuls à avoir étudié sėrieusement la question des résidus sont les archéologues et les environnementalistes. Les développeurs de procédés industriels ont aussi leurs compétences mais là, il s'agit de rendement, de compétitivité et de concurrence donc ils publient le moins possible. Du coup, on en sait plus sur les résidus ancien que sur les récents. La métallurgie, c'est en quelque sorte de la géologie à l'envers: toutes les histoires commencent par "il était une fois un minerai" puis on cherche comment défaire ce que la nature a si bien fait. Pas étonnant si les résidus finissent par ressembler aux matériaux de l'univers primordial.
-
Pour répondre à jjnom, le taux de calcium est élevé dans certains minéraux, comme à Pribram mais sur le présent sujet, je n'ai pas vu d'analyse globale. On pu utiliser la castine comme fondant même dans la métallurgie du plomb mais le calcium est extrêmement répandu dans la nature, pas besoin de cette hypothèse. Romt20, les laitiers sont des déchets, les métallurgistes ne passent leur temps à photographier leurs fonds de poubelles... Ce sera dur de retrouver une photo sur le web. Mais quand on refroidit un matériau fondu, on peut obtenir différents aspects. Cet aspect régulier est plutôt signe d'une faible viscosité.
-
Très intéressante la thèse, merci jjnom. L'extraction du cuivre est une autre possibilité. Je suis quand même d'accord avec romt20 sur un point: c'est trop régulier pour un résidu ancien. Ça ressemble plus à un résidu industriel récent.
-
Les minerais importés sont souvent pollués par l'eau de mer. Quand on fond un minerai contenant des chlorures, on obtient des chlorures à la sortie. Ça n'a rien de mystérieux.
-
Relisez ce que j'ai écrit. On évite les sulfures en sidérurgie, c'est à dire la métallurgie du FER. Je vous parle de la métallurgie du PLOMB dont le principal minerai est un SULFURE. La présence de sulfures, de baryum, de zinc etc... sont des indices en faveur de la métallurgie du plomb.
-
Comment pouvez-vous affirmer qu'il y a trop de soufre pour un déchet sans analyse globale? Pour moi, l'hypothèse la plus plausible est un résidu de la métallurgie du plomb. L'origine pourrait bien être l'ancienne usine de Couëron ou celle de Tonnay-Charente.
-

Métal, sûr... mais quoi ?
mr42 a répondu à un sujet de Cath-de-la-Caille dans Demandes d' identification de minéraux
Un calcul de densité à la grosse louche. Comme il est assez plat, ça doit être faisable. En gros 26 centimètres carrés sur la première photo. Un épaisseur max de 1,3 cm, ça doit plutôt faire 1 cm en moyenne (il y a quelques trous) soit un volume de 26 centimètres cubes, donc une densité proche de 8. Acier possible, mais peut-être alliage cuivreux... Si ça ne réagit pas à l'aimant, ça pourrait être un acier inoxydable austénitique mais la couleur fait un peu bizarre : tout dépend dans quoi il a pu traîner. D'après la couleur, plutôt un bronze ? Il faudrait essayer de voir l'intérieur soit avec un bon coup de lime sur un côté, soit en le coupant en deux avec une scie à métaux (ça risque d'être coriace...) -
Pas grand chose à apporter concernant les fossiles mais la forge de Buffon mérite de petit clin d’œil. http://www.grandeforgedebuffon.fr/
-

La séparation de l'argent dans le minerai?
mr42 a répondu à un sujet de said.saad dans Demandes d' identification de minéraux
Tout à fait d'accord avec Steph. Avant de proposer une méthode, il faudrait quand même savoir de quel minerai on parle. Les minerais permettant l'extraction directe de l'argent sont rares. La plupart du temps, l'argent est est un sous-produit du cuivre, du plomb, du zinc... Selon le métal principal, le procédé ne sera pas le même. On commence par extraire le métal du minerai et on obtient du cuivre, du plomb, du zinc... avec une faible teneur en argent. Dans un deuxième temps, il faut extraire l'argent du métal. C'est là qu'interviennent des méthodes comme la coupellation. Cette dernière ne permet pas de traiter directement le minerai.