Quelques-uns des principaux sujets de Géoforum
 ▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲ |

▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲
-
Compteur de contenus
1900 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Tout ce qui a été posté par mr42
-
Allez, juste pour détendre l'atmosphère: https://www.youtube.com/watch?v=5CuqIaaxfA8 et pour me faire pardonner, une linarite de la mine de Durelle, à Juré dans la Loire. Champ de 1,4 mm.
-
Troll ou syndrome d'Asperger? Dans les deux cas, les moqueries n'avanceront à rien.
-

La géologie prétend que la lune tournait plus près de la terre autrefois
mr42 a répondu à un sujet de alain gouvenaux dans Forum Géologie
Discussion visiblement stérile: http://www.webastro.net/forum/showthread.php?t=1721 -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Je crois que nous sommes d'accord. La partie commune, le spectrographe, ne pose pas de gros problèmes même si les paramètres ne sont pas exactement les mêmes dans les deux domaines. Pour moins de 100 euros et sans être un génie du bricolage, on peut construire un appareil qui tient la route. La vraie difficulté, en astronomie comme avec les minéraux se trouve en amont : comment obtenir un signal exploitable. Et là, malheureusement, les solutions sont très différentes et absolument pas transposables. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
J'utilise également un réseau que j'ai acheté 40 euros chez Jeulin il y a quelques années. C'est la partie la plus chère du spectrographe, je ne compte pas l'appareil photo. Il semblerait que ce type de réseau marche aussi en astronomie : http://www.astrosurf.com/cieldelabrie/spectro.htm http://www.astrosurf.com/buil/spectro3.htm http://www.astrosurf.com/buil/us/stage/session0/stage1.htm Pour ce qui est de la luminosité, c'est surtout une question de temps de pose. Dans les exemples ci-dessus, il va d'une fraction de seconde à quelques secondes pour un résultat rudimentaire. Pour des résultats plus fins, certains annoncent des temps de pose d'une heure ce qui oblige à avoir un dispositif de suivi. Est-ce que ce n'est pas indispensable dès que l'on veut faire de la bonne photo en astronomie ? -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
La diffraction est assurée par une fente réalisée avec deux morceaux de lame de cutter mais je ne pense pas que la fente joue le même rôle qu'en spectroscopie stellaire dans la mesure où les étoiles apparaissent comme quasiment ponctuelles. Je ne vais pas trop parler d'astronomie car ce n'est pas mon domaine mais il y a quand même des astronomes amateurs qui ont réalisé eux-mêmes leur spectrographe ou -scope. Voir par exemple : http://francois.cochard.pagesperso-orange.fr/spectrobr1000.htm On trouve de nombreux conseils et explications sur astrosurf : http://www.astrosurf.com/aras/bareges/bareges.htm http://www.astrosurf.com/aras/design/design_fr.htm Il y en a encore plus si on ne se limite pas aux sites francophones : http://www.cloudynights.com/topic/512705-3d-printed-spectrograph/ http://www.lpl.arizona.edu/~rhill/spect/spect.html http://www.astroimagem.com/Espectro/construc01.html Je ne vois pas ce que je vais leur apporter... -
Je dirais même plus, très impressionnant... Avec des pixels de 0.,4 microns, c'est à peine si on voit des franges de diffraction... La deuxième photo, c'est un recadrage de la première?
-

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Merci Loïc pour ce rappel. J'avais déjà signalé ces risques à diverses reprises, il est bien que quelqu'un d'autre en parle. Mais ça reste gérable. D'un côté le risque est lié à l'utilisation de matériaux pulvérulents potentiellement toxiques portés à haute température. On est dans la même situation que lors d'un test de couleur de flamme: éviter tout contact avec les poudres et avec les émanations gazeuses. Il est préférable d'avoir une petite idée préalable de ce que l'on va tester. De l'autre côté le risque électrique fait l'objet de normes de sécurité. On peut se conformer à ces dernières en limitant l'énergie délivrée à chaque décharge. La spectrographie est un outil de base en astronomie. Les astronomes professionnels et même amateurs utilisent courament cette méthode. Certains amateurs ont bricolé eux-mêmes leur installation; c'est en visitant divers forums d'astronomie que je me suis persuadé que c'était possible dans notre domaine. Les astronomes peuvent être intéressés mais ils sont certainement en avance sur ce qui est présenté ici. La comparaison s'arrête au spectrographe et à l'exploitation des mesures car les astronomes étudient des objets inaccessibles mais naturellement lumineux alors que les minéraux doivent subir un traitement approprié. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Bonjour Néodyme, l'automne s'annonce productif ! En ce qui concerne les électrodes, je pense que le graphite est nettement préférable. Je ne sais pas s'il est utile de réaliser un creuset, je me contente déposer l'échantillon sur une petite électrode plate en graphite. Pour le nettoyage, c'est finalement assez pratique : un lavage à l'eau, un coup de lime et c'est reparti. Les électrodes en métal vont produire des raies parasites. Avec le tantale ou le tungstène, ça risque de devenir très envahissant mais peut-être que les électrodes ne fondront pas... Je serai curieux de voir le spectre du tantale... J'ai fait quelques essais avec des électrodes en aluminium, c'est aussi un choix possible : le spectre est assez discret dans le visible et au prix de l'aluminium ça devient du consommable. Pour le mortier et le pilon, on peut dans un premier temps se contenter de produits en porcelaine, c'est ce que j'ai fait jusqu'à ces dernières semaines. Ceux que j'utilise m'avaient coûté 3 ou 4 euros au rayon cuisine d'une grande surface. On doit pouvoir repérer les vendeurs en cherchant sur le web « mortier pilon céramique » ou encore « mortier pilon cuisine », il y a des sites d'ustensiles de cuisine qui en proposent à moins de 10 euros. Pour trouver des outils en alumine, il vaut mieux faire une recherche en anglais : « alumina mortar and pestle ». Le produit qui revient le plus souvent est fabriqué par Coors Tek, c'est celui que j'ai acheté et pour l'instant, je n'ai rien à lui reprocher. Il est proposé par divers revendeurs et il vaut mieux comparer les prix, c'est plutôt autour de 150 euros. Je ne pense pas utile de commencer par là. Il y en a d'autres proposés par des sites extrême-orientaux mais les descriptifs sentent un peu trop la traduction automatique. Bon bricolage ! -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
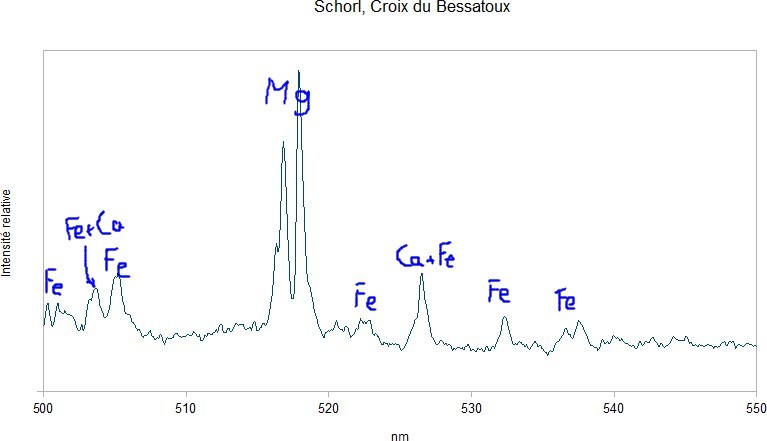
Le fer, qui doit être massivement présent dans les schorls réagit faiblement. On observe quelques raies de faible intensité en zoomant sur la plage 500-550 nm. Il est difficile d'en déduire quelque chose sur la proportion fer/magnésium. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
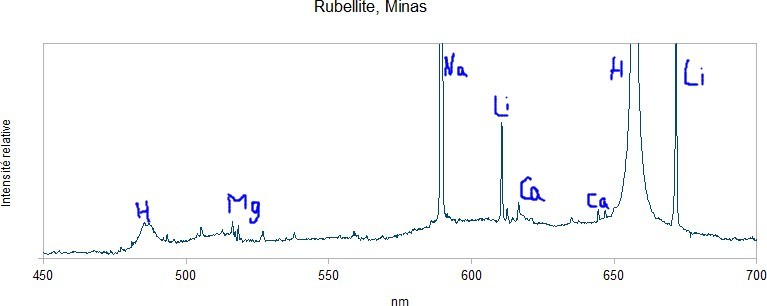
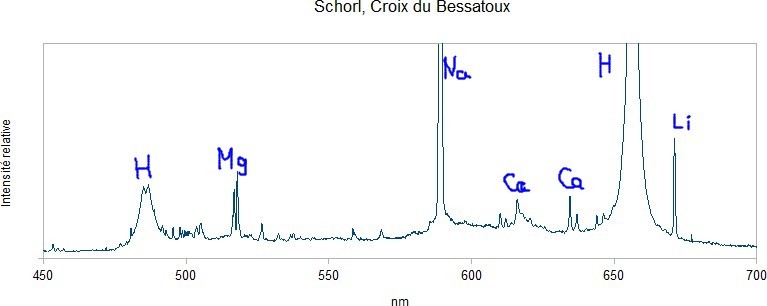
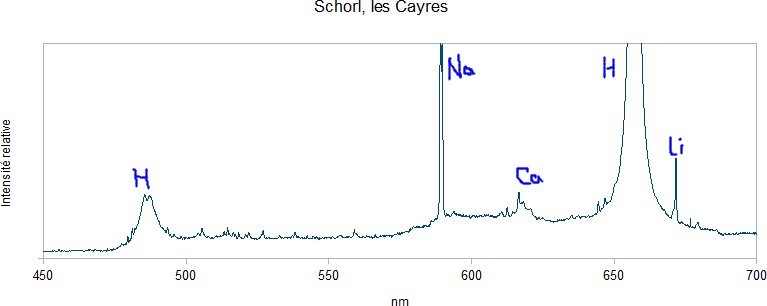
Premier essai avec 3 échantillons de tourmaline : - une rubellite du Minas, - un schorl de la Croix du Bessatoux, près de Saint-Pierre-la-Bourlhonne, Puy-de-Dôme, - un autre schorl des Cayres, près de Saint-Chély, Lozère. Les échantillons semblent homogène sous la binoculaire mais on ne peut pas exclure des petites inclusions ni des adhérences de la matrice. La composition chimique des tourmalines, c'est un peu la pochette-surprise. On oublie l'hydrogène qui vient de l'acide chlorhydrique introduit pour les besoins de la manip ainsi que le sodium qui est une impureté de l'acide commercial acheté en grande surface. Le premier élément intéressant qui ressort, c'est le lithium. Il crève l'écran avec la rubellite mais il est bien visible avec les deux schorls. Ça ne veut pas dire qu'il y en a beaucoup, le lithium est un peu comme le sodium, il réagit même à faible dose. Le magnésium est bien visible sur l'échantillon de la Croix du Bessatoux, nettement moins sur la rubellite et à peine détectable sur l'échantillon des Cayres. On note également la présence de calcium sur les 3 échantillons. -

Spectrographie et identification des minéraux
mr42 a répondu à un sujet de mr42 dans Forum Minéraux et Minéralogie
Un petit investissement qui a coûté aussi cher que le reste de l'installation : un pilon et un mortier en alumine qui devraient venir à bout de la plupart des minéraux. -
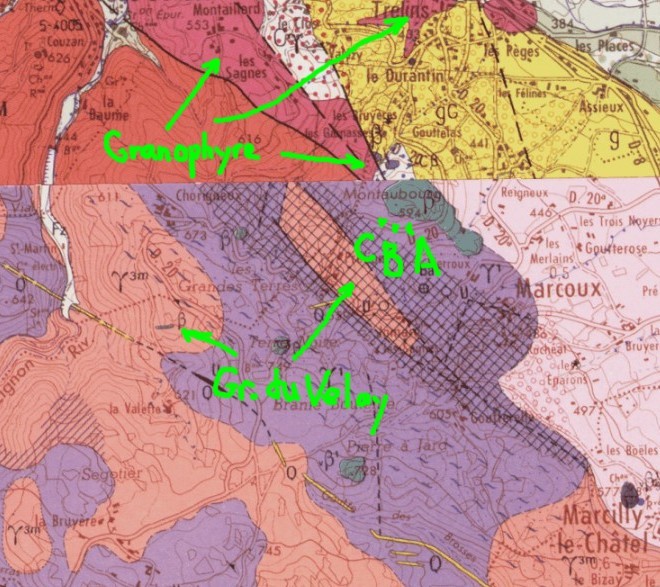
Après tous ces échanges, la question initiale semble à peu près réglée, un grand merci pour toutes vos contributions. En résumé : - Les cristaux hexagonaux pourraient bien être de la cordiérite ou ce qu'il en reste. Ce n'est pas certain mais c'est la seule hypothèse qui tienne la route. - Sur cette base, la roche en question (point A) pourrait se rattacher aux granites du Forez-Velay. Les leucogranites (point C) ne sont pas loin, environ 200 mètres sur le terrain. - Mais entre les deux, point B, il y a quand même quelque chose de différent... Pour éclaircir ce dernier point, il va falloir : - que je retourne sur le terrain pour disposer de plus d'éléments, - et peut-être ouvrir un nouveau sujet.
-
Pour Lucailloux : pas de mica noir à proximité immédiate. Les trucs verdâtres, c'est la même matière que les cristaux du message 8 mais pour la cordiérite je n'ai pas plus de certitudes et si c'en est, elle est en état de décomposition avancée. Serge : si ce sont des grenats, alors ce sont des faces de dodécaèdres rhomboïdaux, voir la 3ème photo. Il y a pas mal de grenats dans le secteur mais jusqu'à présent, je n'ai vu que des trapèzoèdres. Il me semble que les trapèzoèdres sont plutôt typiques des granites et les dodécaèdres des roches métamorphiques.
-
En examinant une fois de plus ces cailloux, je découvre un autre aspect intéressant de cette roche à cristaux hexagonaux : La présence de rares et minuscules cristaux roses, transparents avec des faces qui brillent comme des miroirs. Grenat possible mais pas convaincant... Les trucs verdâtres pourraient être de la cordiérite. Le champ est de 1,4 mm pour les 3 photos.
-
Pour gb69 : j'ai testé la dureté sur les côtés, ce n'est pas mieux. Pour jjnom : je comprends tous ces arguments et je n'ai rien d'irréfutable à leur opposer. Le granophyre de Boën s'étend sur une centaine de km2 et présente des variations notables. Les phénocristaux sont fréquents mais leur répartition est irrégulière. L'échantillon du message 13 vient bien de la carrière de Boën et ne peut être mis en question. Ce n'est pas dans cette carrière que l'on voit le plus de phénocristaux, on peut voir des tonnes de cailloux sans phénocristaux. Une autre caractéristique de la carrière de Boën est l'alternance de plages roses et grises que l'on retrouve sur l'affleurement dont je parle ici. Sur les caractéristiques macroscopiques, rien ne distingue B du granophyre de la carrière à part la taille des grains. J'aurais du mal à trouver dans les environs un échantillon de granite « du Velay » qui présente un aspect aussi proche. Seule une lame mince permettrait d'en dire plus.
-
C'est clair, la carte ne peut pas donner tous les détails, surtout dans une région autant cisaillée. Mais quand même, les zones à cordiérite sont indiquées sur la carte et trop éloignées pour parler d'imprécision. Et quand il y a de la cordiérite, elle ne forme pas des cristaux aussi nets. La dureté ne nous apprendra pas grand chose, les cristaux se laissent entailler avec un couteau. Si c'est bien de la cordiérite, elle n'est plus très fraîche. Une photo du granophyre prélevé dans la carrière de Boën qui est la référence pour cette formation à comparer à la photo du deuxième message. Le champ est également de 20 mm. Ce n'est pas décisif mais à part le grain plus fin, l'aspect est très proche.
-
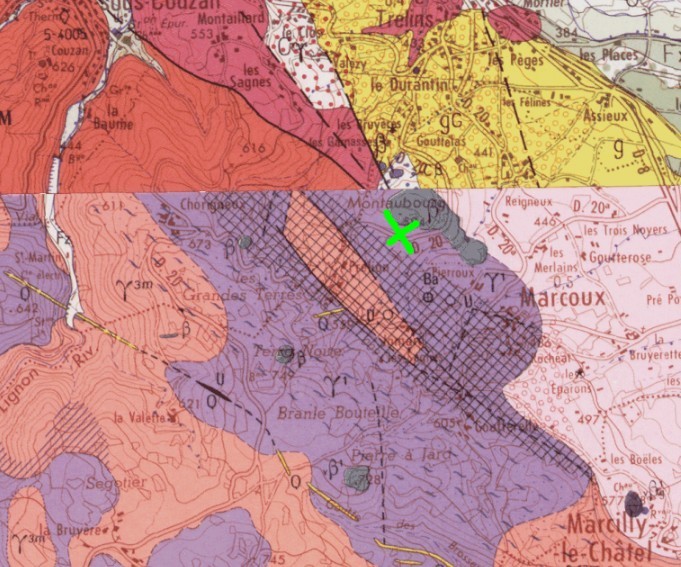
Merci pour la référence, je vais examiner ce document. Dans le cas présent, cela signifierait une interpénétration du granophyre et du granite du Velay, ce qui est assez nouveau… Mais avec les nombreuses failles du secteur c’est envisageable. Un petit résumé de la situation les points indiqués sur la carte correspondent aux 3 prélèvements : A pour la roche brune du 1er message, B pour le supposé granophyre du 2ème message C pour le granite à muscovite du 2ème message. En C tout va bien, leucogranites sur la carte comme sur le terrain. En B, une certitude, ce n’est plus le leucogranite. Ça ressemble beaucoup au granophyre même si ce n’est pas certain. Et en A on retrouverait le granite du Velay… Malheureusement les affleurements sont discontinus et de mauvaise qualité. Il n’est pas possible de suivre les transitions entre ces 3 faciès sur le terrain.
-
La cordiérite, oui, c’est une idée intéressante. La plupart des cristaux sont en forme de tablettes assez minces mais certains (voir deuxième photo ci-après) sont à peu près aussi épais que larges. De toute façon, les cristaux visibles sont tous plus ou moins cassés, difficile de connaître leur longueur initiale. On voit également (mais c’est assez rare, première photo ci-après) des cristaux gris qui pourraient être de la cordiérite pas encore transformée en mica. Cette hypothèse amène quand même des questions. La carte et sa notice ne signalent pas de cordiérite ni dans les leucogranites, ni dans le granophyre ni dans les autres formations voisines alors que dans cet affleurement elle serait un des constituants majeurs. De quel type de roche s’agit-il ? Et comment s’intègre-t-elle dans le contexte géologique local déjà assez complexe ? La carte indique une zone à cordiérite dans le granite du Forez-Velay mais à une dizaine de km. Champ 4 mm pour les deux photos.
-
Merci pour ces réponses. Les photos ne sont peut-être pas assez bonnes. La netteté des contours des cristaux de mica (à vérifier bien entendu) est quand même inhabituelle pour un granite. D’autre part, les feldspaths (s’il y en a) ne montrent aucun plan de clivage ce qui est encore plus rare pour un granite. La carte géologique du secteur n’est pas très précise. Il n’y a qu’à voir les raccords entre les deux feuilles voisines. Dans la « Géologie de la Loire » de Georges Vitel (Publications de l’Université de St Etienne, 2001) on trouve une coupe du secteur qui montre le granophyre beaucoup plus étendu que sur la carte et notamment présent à l’endroit où j’ai trouvé l’échantillon de la première photo du deuxième message. Bien entendu l’aspect visuel ne suffit pas pour dire que c’est un granophyre mais cet aspect est très proche de ce qu’on trouve dans la carrière de Boën qui est la localité type pour cette formation et ne ressemble à aucune autre formation connue du secteur. Après deux tests rapides, la pyrrhotite semble peu probable : - après plusieurs heures dans l’acide chlorhydrique, il n’y a aucune dissolution visible, pas même une coloration jaune de l’acide, - pas d’effet magnétique détectable avec une boussole.
-
Pour le contexte, on peut se reporter à la carte géologique, feuille Montbrison. Dans le voisinage immédiat, on trouve 3 formations bien identifiées sur la notice : - des granites à muscovite, - le granophyre de Boën, - les formations volcaniques de Montaubourg qui recouvrent partiellement les deux précédentes. Compte tenu de la répartition des minéraux sombres, cette roche brune semble plus proche du granophyre. Les différences pourraient s'expliquer par un métamorphisme de contact causé par le volcanisme... Qu'en pensez-vous ? Champ 20 mm pour les 2 photos: granophyre et granite à muscovite.
-
Un affleurement curieux au bord de la RD20 près de Marcoux, Loire. Quand on passe un peu vite, on croit ne voir que de la terre mais en regardant de plus près, il s'agit bien d'une roche dure et compacte, pas si altérée que ça. Elle comprend : - une pâte ocre dans laquelle on a du mal à distinguer des cristaux, - des globules de quartz, - des cristaux gris foncé tabulaires et hexagonaux avec des contours particulièrement nets et un fort clivage. Pour ce derniers, j'ai 'impression qu'il s'agit de biotite un peu défraichie. Champ : 20 mm pour la première photo, 3 mm pour la seconde.
-

Identification de quelques micro minéraux
mr42 a répondu à un sujet de mr42 dans Demandes d' identification de minéraux
Avec de trucs aussi petits, il y aura toujours une place pour le doute. Mais c'est aussi l'intérêt de ce genre d'exercice, mieux connaître les limites et pourquoi pas, de temps en temps, les repousser. Il y a une certaine symétrie qui colle assez bien avec le système orthorhombique. Avec d'autres systèmes, ce sera plus compliqué mais pas impossible. En parcourant les photos sur mindat, l'anglésite présente assez souvent cette configuration, c'est plutôt rare pour la cérusite. Ici, on est dans une petite cavité qui contient également de la galène et de la cérusite. Il y a aussi de la barytine massive pas très loin mais il est quand même plus probable qu'il s'agisse d'un composé de plomb. -

Identification de quelques micro minéraux
mr42 a répondu à un sujet de mr42 dans Demandes d' identification de minéraux
La cérusite, je n'y avais pas pensé. Il y en a également sur ce caillou mais elle présente une forte fluorescence que je ne retrouve pas sur ces petits cristaux. Encore que, sur la deuxième photo, ils prennent une légère teinte orange mais c'est peut être une réflexion de la lumière émise par la cérusite? -

Identification de quelques micro minéraux
mr42 a répondu à un sujet de mr42 dans Demandes d' identification de minéraux
A votre bon cœur, Quelqu'un aurait-il un avis sur le cristal du message précédent ? Peut-on penser sans faire de test et uniquement sur l'aspect visuel que c'est bien une anglésite ou qu'il y a risque de confusion avec un autre minéral ? Merci d'avance.