
▲ Bourse minéraux et fossiles de Sainte Marie aux Mines (Alsace) - 26>30 juin 2024 ▲ |
-
Compteur de contenus
1858 -
Inscription
-
Dernière visite
Type de contenu
Profils
Forums
Galerie
Blogs
Boutique
Messages posté(e)s par mr42
-
-
Merci pour cette réponse. J’ai cité l’article de Marine Geology car c’est le seul que j’ai trouvé.
Je ne suis pas qualifié pour juger des arguments géologiques mais je note quand même quelques points faibles.
Les échantillons ont été trouvés en milieu sédimentaire sans lien clair avec leur contexte de formation et sans minéraux associés.
L’origine anthropique me semble trop vite écartée. La pureté n’est pas un bon argument, les analyses présentées sont compatibles avec de l’aluminium d’extrusion qui ne comporte le plus souvent aucun élément d’alliage.
J’irais même plus loin car si on a réuni des conditions permettant la réduction de l’aluminium, alors on peut réduire la plupart des métaux. Il n’y a guère que quelques composés de Ca, Mg, Na, K qui pourraient résister. Dans ces conditions, on devrait obtenir un aluminium très impur avec notamment une forte teneur en silicium. Le raffinage de l’alumine est une étape clé dans la production industrielle d’aluminium.
Savez-vous s’il existe d’autres références permettant d’y voir plus clair ?
-
Cette question assez simple en soulève une autre nettement plus ardue :
Comment des éléments aussi difficiles à réduire que l’aluminium ou le silicium peuvent-ils se
retrouver à l’état métallique natif à partir de processus naturels ?
On peut difficilement invoquer un processus de nature thermochimique. Les réducteurs possibles pourraient être l’hydrogène ou le carbone. Industriellement, on sait réduire la silice en silicium par réaction avec le carbone à haute température dans un four à arc. On aimerait décarboner le procédé en remplaçant le carbone par l’hydrogène mais aucune solution viable n’a été trouvée.
L’aluminium est encore plus difficile à réduire que le silicium. Il est essentiellement produit par électrolyse.
L’article suivant propose un mécanisme pour la formation de silicium natif : un phénomène non thermochimique (l’impact d’une météorite) permet la formation temporaire d’un radical moléculaire SiO qui se décompose en Si + SiO2.
https://www.hou.usra.edu/meetings/lpsc2014/pdf/1090.pdf
Un autre article invoque également l’intervention d’un processus non thermochimique qui peut être un impact mécanique mais aussi la foudre :
https://www.lpi.usra.edu/meetings/lpsc2011/pdf/2231.pdf
En ce qui concerne l’aluminium, je n’ai rien trouvé d’équivalent.
L’article suivant tente de relier la présence de particules d’aluminium retrouvées dans des sédiments de l’océan indien à une activité hydrothermale. Le processus reste vague. Je suis très sceptique sur la possibilité de réduire l’aluminium à partir d’hydrogène, surtout en milieu aqueux.
https://drs.nio.org/drs/bitstream/handle/2264/621/Mar_Geol_240_177.pdf?sequence=1
Quelqu’un a-t-il des idées sur l’origine de l’aluminium natif ?
-
Ni l’aluminium ni le silicium métalliques ne sont stables dans les conditions habituelles. Il se combinent de façon irréversible avec l’oxygène de l’air en alumine ou en silice. Si on peut conserver du silicium ou de l’aluminium métalliques, c’est parce qu’il se forme une fine couche d’oxyde protecteur invisible à l’oeil nu mais suffisamment étanche pour empêcher l’oxydation de se poursuivre. À l’inverse du fer qui se couvre de rouille car la rouille ne forme pas une barrière continue et l’oxydation peut se poursuivre jusqu’au coeur de l’objet. L’acier dit inoxydable contient du chrome et c’est une fine couche d’oxyde de chrome qui bloque l’oxydation.
Pour séparer de l’aluminium ou du silicium de leurs oxydes respectifs, il faut des conditions extrêmement réductrices. Il paraît que ça existe au moins pour l’aluminium.
Je serais quand même curieux de savoir quelles circonstances ont permis d’obtenir de l’aluminium métallique de façon naturelle.
-
On pourrait ajouter la fluorine qui cristallise également dans le système cubique. La fluorine présente des clivages mais ce ne sont pas les mêmes que ceux de la galène.
Les clivages de la fluorine forment des octaèdres alors que ceux de la galène forment des cubes.
Ou encore l’halite qui donne les mêmes clivages que la galène, le diamant qui donne les mêmes clivages que la fluorine, le grenat qui ne donne aucun clivage… et pourtant ils sont tous dans le système cubique.
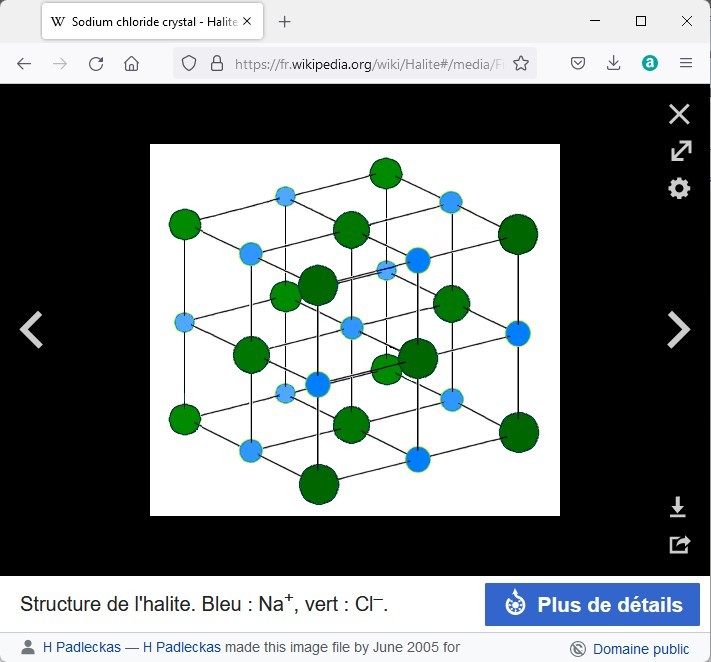
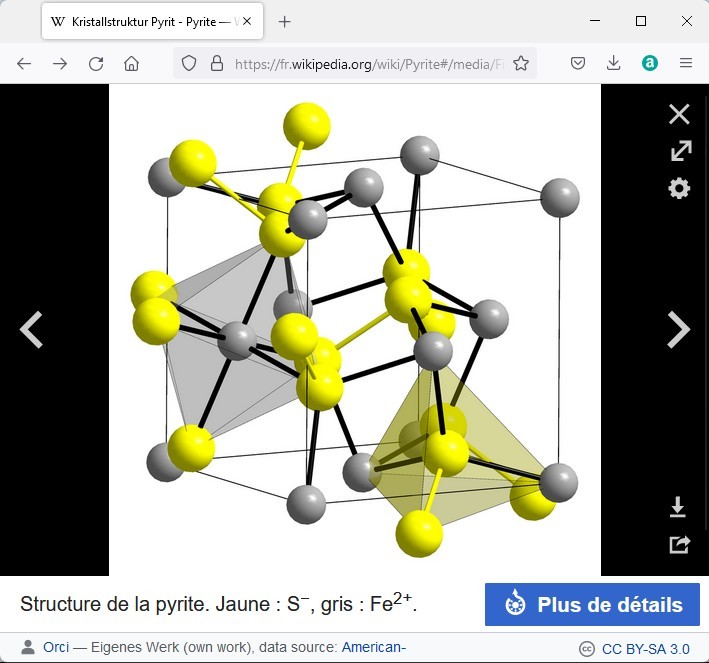
Une partie de l’explication tient à la disposition des atomes. Un cristal est formé par la répétition d’une maille élémentaire comprenant un petit nombre d’atomes.
Voici quelques exemples de mailles élémentaires tirées de wikipedia.


La galène présente la même disposition des atomes que l’halite (chlorure de sodium) et donne les mêmes clivages cubiques. La disposition plus compliquée de la pyrite ne permet pas de clivage facile.
La disposition des atomes n’explique pas tout, il faut également tenir compte de la force des liaisons entre les atomes, de la pureté...
-
On ne brûle pas le minerai, on le réduit. C'est le contraire d'un incinération où l'on cherche à oxyder.
Ici, les traces d’oxydation très marquées, l’aspect un peu galet roulé, tout ça ne colle pas avec un résidu métallurgique.
Voir ici quelques exemples :
https://www.geoforum.fr/topic/35726-les-scories-métallurgiques/
Ce serait bien d’avoir des photos plus nettes, voir s'il y a des bulles...
-
J'ai quand même du mal à y voir un quelconque résidu métallurgique.
Pourquoi pas une roche naturelle?
Ou alors un résidu d'incinération?
Quelques tests seraient les bienvenus: densité, magnétisme, trace...
-
-
Voir Australie
-
Il y a 14 heures, NiCoCaYoU a dit :
Par contre j'ai lu que ça peut être nocif si la pièce est travaillée genre broyage via poussière , je ne suis pas certain de mes dires mais tout en bas de la page wikipédia/silicium ils ont parle.
Pour fabriquer de la poussière de silicium, il faut vraiment le faire exprès, par exemple avec une disqueuse diamant… Ce n’est pas plus dangereux qu’un bout de quartz.
Il y a 13 heures, lisa85 a dit :je suppose que ca doit etre un alliage, car la densité est plus faible, mais j'ai l'élément principal C'est top ! (ou alors j'ai mal fait mes pesées ^^)
Si c’était un alliage, il serait probablement plus lourd que le silicium pur.
Si la densité est aussi faible c’est peut-être parce qu’il est poreux, ou alors il reste des adhérences d’autres matériaux après son séjour dans la nature, ou alors la mesure n’est pas très précise...
-
Aucun danger, on en trouve dans de nombreux appareils électroniques.
-
Silicium de l'usine Ferropem de Livet et Gavet.
-
Loupe de fer venant d'un ancien bas fourneau.
-
Le 24/03/2022 à 08:30, trenen23 a dit :
Ce qui me titille, c'est la taille des olivines, impressionnante pour une simple lave et la présence d'un cristal vert différent qui ressemble beaucoup aux pyroxènes des péridotites.
Il y a aussi une croute de fusion.
Finalement on, pourrait peut être aller sur une scorie métallurgique, faudrait voir ce qu'en pense Mr 42.
Serge
Bonjour à tous,
je n’ai jamais rien vu de semblable mais je suis loin d’avoir tout vu.
De l’olivine dans une scorie, on s’attendrait plutôt à de la fayalite mais elle se présente généralement sous forme de fines baguettes.
Pourquoi ces formes arrondies ? Coalescence ? Ça sent le réchauffé. Une roche bien naturelle qui serait passée dans un four?
Certains globules verts montrent aussi des angles vifs comme s’ils avaient été cassés…
Ce caillou doit avoir une histoire compliquée : les amateurs de lames minces pourraient se régaler.
-
il y a 51 minutes, jojo38 a dit :
Bonsoir mr42,
Quelle différence il y a entre le carborundum et le carbure de silicium?
Merci

Fondamentalement, il n’y a pas de différence. Le problème vient plutôt du mot carborundum qui perpétue une erreur d’identification et qui fait référence au corindon alors qu’il n’y a rien de commun entre les deux composés SiC et Al2O3.
Quand le carbure de silicium a été synthétisé par Acheson vers 1890, le découvreur n’ a pas fait d’analyse chimique mais vu la dureté et le système cristallin, il a conclu que c’était du corindon (corundum en anglais) contenant du carbone. D’où le mot formé en anglais à partir de carbon et corundum.
Un bon exemple des pièges d’une détermination à partir de quelques tests.
-
Il y a 14 heures, JLOUI a dit :
Tout a été dit !
Pas vraiment, c'est du carbure de silicium. Ce n'est pas un résidu de fonderie mais un produit industriel.
-
Scorie de bas-fourneau possible.
-
Il y a 2 heures, lampote a dit :
autre anomalie pourquoi le lac salé dans l’Utah est-il aussi plan?
Ce n'est pas une anomalie, on retrouve la même configuration au Salar d'Uyuni en Bolivie, au lac Eyre en Australie, dans les chotts tunisiens et beaucoup d'autres endroits...
Pour comprendre, on peut regarder l'évolution de la mer d'Aral, c'est le même phénomène accéléré par l'homme.
-
Il y a 15 heures, Géomac a dit :
Fait étonnant la moissanite (carborundum) vendu dans les bijouteries est incolore et non noire à contrario des échantillons-là. Le SiC a plusieurs formes? comme CaCO3 ou même la carbone (graphite vs diamant)?
Ce n’est pas une question de forme mais de pureté.
Le carbure de silicium pur est incolore.
Le carbure de silicium industriel est souvent de couleur verdâtre.
Le mot carborundum vient d’une erreur historique : quand Acheson a découvert ce nouveau produit, il s’est contenté d’un test de dureté et a conclu sans analyse qu’il s’agissait de corindon noirci par du carbone, d’où le mot formé en anglais à partir de carbon et de corundum. Carborundum a survécu comme marque commerciale.
Il est préférable de parler de carbure de silicium.
-
Si c’est brun, ce n’est pas du sel. On utilise aussi du sable, de la cendre, de la pouzzolane (ça ne fait pas fondre la neige mais c’est antidérapant) ou des mélanges de plusieurs produits. Il n’y a pas de solution universelle.
-
-
Le 07/01/2022 à 19:15, phoscorite a dit :
Pour information, la contraction thermique n'est pas la seule origine possible de ce phénomène si spectaculaire.
Des structures columnaires sont observées dans d'autres contextes, en particulier dans la solidification des alliages, et les métallurgistes en ont une compréhension assez différente, qui n'est pas sans intérêt pour les coulées de lave. Un débat existe, et on n'a sans doute pas encore fait le tour de toutes les interprétations alternatives.
J’ai l’impression que ce sont deux phénomènes bien différents.
En fonderie, cette disposition en colonnes est courante mais elles est clairement liée à la croissance cristalline. Chaque colonne est un monocristal. Il n’y a pas de fissures entre les colonnes.
Dans le cas des orgues basaltiques, les colonnes sont délimitées par des fissures. Le lien avec la cristallisation n’est pas évident.
Il devrait être possible de reproduire le phénomène en labo. Quelqu’un a-t-il essayé ?
https://www.geoforum.fr/topic/35726-les-scories-métallurgiques/?do=findComment&comment=617210
-
il y a une heure, AMEDE a dit :
Oui
Non, résidu de combustion.
Couleur rouille = conditions oxydantes. Scorie métallurgique = conditions réductrices.
-
Il y a 12 heures, AMEDE a dit :
C'est dingue ça, pas d'odeurs acides ?
Il n’existe pas d’odeur spécifique des acides. L’acide acétique a une odeur, l’acide nitrique en a une autre mais elles n’ont rien de commun. HCl pique bien le nez sans odeur particulière. Je n’ai jamais essayé HF mais il est moins volatil que HCl.
Quoi qu’il en soit, HF est un produit très dangereux et sournois.
Il y a 23 heures, phoscorite a dit :Pour faire le calcul de la quantité d'acide nécessaire, il faut partir de l’idée que l'on forme du Si6F6 qui est volatil.
Curieux ?
J’avais entendu parler de SiF4 gazeux et de H2SiF6 en solution...
https://www.sciencedirect.com/topics/chemical-engineering/hydrofluoric-acid
Mais passons au choses importantes : joyeux Noël à tous !
-
Débat intéressant auquel je serai tenté de répondre qu’il n’y a pas de grande découverte sans deux ingrédients majeurs : le hasard et le travail. C’était vrai autrefois et ça l’est toujours.
Tu parlais récemment du bleu YInMn découvert en 2008. Subramanian et Smith cherchaient des matériaux pour l’électronique et se moquaient pas mal de la couleur, ils ont du tester diverses compositions mais c’est bien par hasard qu’ils sont tombé sur un composé avec ce bleu intense.
Si je prends un exemple que je connais mieux, celui du haut-fourneau, on retrouve bien ces deux facteurs. Les premiers hauts-fourneaux datent de la fin du moyen-âge : personne avec les connaissances chimiques et physiques de l’époque ne pouvait imaginer un tel dispositif.
On peut donc supposer que les anciens métallurgistes ont surtout cherché à augmenter leur capacités de production et à construire des fours de plus en plus grands. Et ils ont du se rendre compte qu’à partir d’une certaine hauteur, le fonctionnement n’était plus le même : ils arrivaient à fondre le métal tout en améliorant le rendement de l’installation. Mais le métal n’avait plus les mêmes propriétés : c’était en fait de la fonte, plus cassante que le fer ou l’acier et qui devait encore être affinée. Le hasard, c’est clair et également le travail car il a fallu construire de nombreux appareils avant d’y arriver.
Avant Lavoisier, il n’était pas possible d’expliquer ce fonctionnement. Dans l’encyclopédie de Diderot et d’Alembert, il est écrit que la hauteur d’un haut-fourneau doit être d’au moins 4 mètres sans donner de raison scientifique. Au 18ème siècle la théorie dominante était celle du phlogistique, fluide mystérieux apporté par le combustible et qui venait se mélanger au fer.
Réaumur écrit que l’acier est un fer surchargé en phlogistique. Pour transformer la fonte en acier, on lui ajouterait du phlogistique alors qu’en réalité, il faut lui retirer du carbone. Ce qui a conduit à une découverte surprenante : le phlogistique devait avoir une masse négative !
La découverte de l’oxygène par Priestley et l’explication de son rôle par Lavoisier ont permis de lever cette incompréhension et de comprendre les réactions qui se produisent lors de la production du fer et de l’acier.
La chimie moderne est donc arrivée après la bataille mais son apport n’a pas été négligeable, elle a permis d’augmenter les rendements, de traiter des minerais plus variés. Les scories des hauts-fourneaux modernes contiennent 10 fois moins de fer que celles du 18ème siècle.
La découverte de la peinture à l'huile résulte probablement d'une histoire aussi complexe.






Absence silicium natif sur Terre
dans Forum Minéraux et Minéralogie
Posté(e)
Merci pour ce nouveau document beaucoup plus fouillé que celui que j’avais trouvé.
L’argument métallurgique est toujours le même et ne tient pas la route. Le grade 1050 contient au minimum 99,5 % d’Al et il est mondialement utilisé pour la fabrication de profilés. Voir les spécifications ci-jointes :
https://lugand-aciers.fr/la-1050-alliage-daluminium/
Je crois de moins en moins à la possibilité d’une réduction directe à Al0 qui donnerait inévitablement un métal impur.
Le papier de Dekov propose néanmoins une voie qui permettrait de sortir de cette impasse en passant par un niveau intermédiaire Al+1.
La formation (dans des conditions qui restent à préciser) d’une molécule telle que AlCl normalement instable présente deux points forts :
- ce serait une voie spécifique de l’aluminium qui expliquerait la pureté élevée,
- le niveau d’oxydation +1 serait peut-être plus facile à obtenir que le niveau zéro.
Le métal serait ensuite produit par dismutation.
C’est un processus assez proche (mais quand même bien compliqué) de celui proposé pour le silicium par Nazarov.