Géoforum est un forum de géologie, minéralogie, paléontologie, volcanologie et, plus généralement, un site dédié aux Sciences de la Terre et au patrimoine géologique. Les discussions s'organisent dans des espaces spécifiques, il existe un forum géologie, un forum minéraux, un forum fossiles, un forum volcans, etc. Une galerie de photos de minéraux ou de roches, de photos de fossiles, ou encore de sites géologiques ou de volcans permet de partager des albums. Il est possible de publier des offres d'emploi de géologue, ou des demandes d'emploi ou stage de géologues. Venez poser vos questions, partager vos connaissances, vivre votre passion !
Quelques-uns des principaux sujets de Géoforum
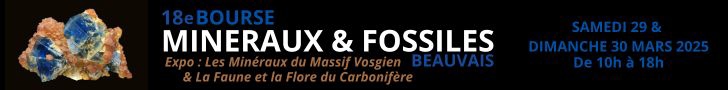
▲ Bourse aux minéraux et fossiles de Beauvais les 28 et 29 mars ▲
|
|
Messages recommandés
Rejoindre le sujet et participer
Pour poster un message, il faut créer un compte membre. Si vous avez un compte membre, connectez-vous maintenant pour publier dans ce sujet.